Seleção do pilar e sucesso no longo prazo
Julia-Gabriela Wittneben sobre seleção do pilar baseada na indicação
A seleção do pilar do implante para cada caso de paciente é uma parte importante da fase de tratamento protético de implantes. Estudos clínicos de longo prazo sobre reconstruções fixas implantossuportadas mostram baixas taxas de complicações técnicas em relação ao pilar em si [1]. Neste artigo, Julia-Gabriela Wittneben discute os diferentes tipos de pilares de implantes, os diversos materiais dos pilares e suas indicações clínicas. Um caso clínico, apresentando o passo-a-passo do tratamento de um único espaço edêntulo com uma coroa de implante aparafusada toda em cerâmica, é mostrado aqui.
1. Tipos de pilares de implantes
Os pilares de implantes podem ser padrão ou personalizados (Fig. 2). A utilização de um pilar padrão é indicada se o implante for instalado em uma posição protética quase ideal. As vantagens dos pilares padrão são tempo eficiência de tempo no tratamento geral e, portanto, redução do tempo de fabricação técnica. As divergências entre os implantes que suportam próteses de várias unidades podem ser corrigidas com pilares padrão angulares. Na zona estética, é importante que a altura do colar de um pilar pré-fabricado não seja uniforme nos 360 graus, já que a posição interproximal da margem da coroa seria instalada muito distante submucosamente. Portanto, o modelo ideal de um pilar padrão deveria ser semelhante a uma preparação do dente, seguindo o contorno da margem gengival2 (Fig. 1 ). Existem limitações clínicas a respeito da posição do implante em uma dimensão vertical. Se o implante for instalado muito apicalmente, os pilares padrão não serão indicados, especialmente para reconstruções aparafusadas, já que eles não suportam suficientemente a cerâmica de revestimento.
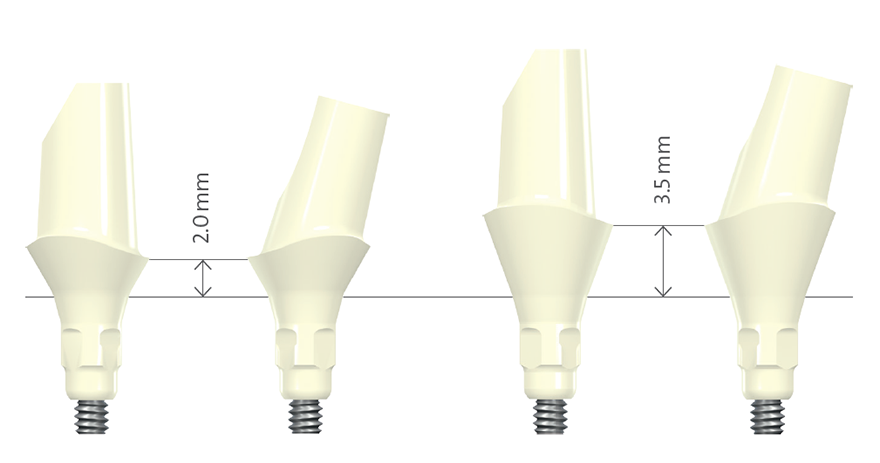
Fig. 1: Pilares padrão feitos de dióxido de zircônia
Personalizar um pilar dá ao dentista a liberdade para individualizar a sua posição e angulação. No caso de um implante de nível ósseo, também é possível individualizar o perfil de emergência e a posição da margem da coroa futura na restauração definitiva. Isso permite que os pilares sejam projetados para fornecer o suporte ideal para o material cerâmico de revestimento, especialmente para reconstruções aparafusadas. A individualização pode ser obtida usando a tecnologia CADCAM, pilares de ouro produzidos com os tradicionais métodos de fundição por cera perdida, ou pilares de titânio (Fig. 2). Os pilares personalizados fabricados através de CADCAM podem ser produzidos com titânio ou de dióxido de zircônia para implantes de nível de tecido e osso. Eles podem ser usados para coroas unitárias cimentadas ou aparafusadas ou próteses fixas múltiplas cimentadas. Os benefícios do pilar com CADCAM incluem a possibilidade de utilizar um material cerâmico de alto desempenho, o que oferece muitas vantagens, especialmente em locais estéticos. Em pacientes com um biotipo de tecido fino, o brilho acinzentado não será visível com um pilar de cor branca. No entanto, também é possível escolher o titânio como material. Outra vantagem é a individualização em relação à angulação e modelo do pilar para apoiar a cerâmica de revestimento.
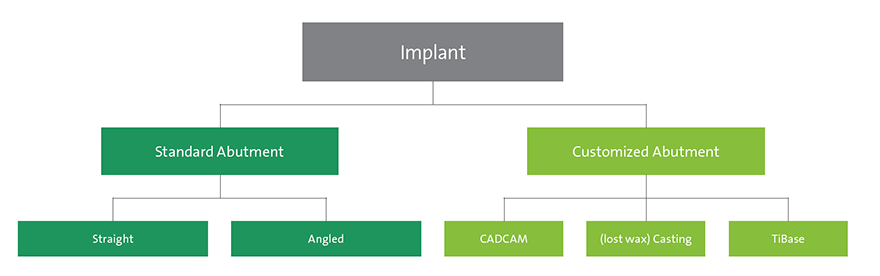
Fig. 2: Árvore de decisões para pilares
Os pilares de ouro tradicionais podem ser usados para coroas unitárias e próteses fixas múltiplas aparafusadas e cimentadas, e estão disponíveis para implantes instalados no nível do tecido ou do osso. Suas vantagens consistem na facilidade da retenção aparafusada de próteses fixas múltiplas. As desvantagens, no entanto, são que os pilares de ouro são sensíveis à técnica, requerem mais tempo, e gerar maiores custos de fabricação. Um estudo histológico in vivo em cães demonstra que as ligas de ouro também têm desvantagens em termos de integração dos tecidos moles. Histologicamente, demonstrou-se uma mudança apical do epitélio de barreira e o osso marginal ao redor de pilares de liga de ouro3. O terceiro grupo de pilares personalizados nos implantes são os pilares de titânio. São pilares de duas unidades com uma base de titânio. Os dentistas, às vezes, se preocupam com o monitoramento das complicações com um pilar cerâmico total, em relação à recuperação de fragmentos cerâmicos quebrados no implante, o que pode ser difícil. A principal vantagem deste tipo de pilar é que não há nenhum material cerâmico dentro da conexão para implante de titânio. No entanto, a desvantagem reside na falta de evidência nos dados clínicos publicados até o momento. Em particular, permanece desconhecida a reação do tecido mole em relação ao espaço de ligação, especialmente em casos de implante de nível ósseo na zona estética. Por consequência, este tipo de pilar deve ser utilizado considerando-se esta limitação atual 4. No entanto, o uso com implantes no nível do tecido mole com um microgap acima do nível ósseo pode ser uma preocupação menor. Um exemplo de um caso de implante no nível de tecido mole é apresentado passo a passo nas páginas seguintes (Figs. 3-15).
2. Material dos pilares de implantes
Estão disponíveis diferentes biomateriais para pilares de implantes. PMMA (polimetilmetacrilato), titânio e PEEK (Poliéter-éter-cetona) são indicados para pilares de suporte provisórios - especialmente para implantes no nível ósseo - para personalizar o perfil de emergência e individualizar a mucosa peri-implante com condicionamento do tecido mole5. Os materiais de escolha para pilares de restaurações finais são titânio, ouro, dióxido de zircônia e cerâmica à base de óxido de alumínio. O titânio e dióxido de zircônia serão discutidos neste artigo, em relação ao desempenho clínico e histológico. O titânio é o biomaterial de escolha em relação ao comportamento de longa duração e bem documentado sob carga funcional para os tecidos moles e duros. Ele tem excelente biocompatibilidade, resistência mecânica e é resistente à corrosão. É, portanto, o material de pilar de escolha para locais posteriores. No entanto, as expectativas dos pacientes na zona anterior estão aumentando. Em locais estéticos, a espessura da mucosa desempenha um papel importante. Um estudo com animais comparando os diferentes materiais dentários em diferentes espessuras de mucosa demonstrou que o titânio induziu a mudança de cor mais proeminente. O dióxido de zircônia não induziu alterações visíveis de cor na mucos com espessuras de 2 e 3 mm.6 Com o pano de fundo da evidência clínica disponível e revisões sistemáticas, não foram encontradas diferenças entre os pilares metálicos e de dióxido de zircônia quanto ao desempenho clínico baseado nos resultados estéticos, técnicos ou biológicos7,8,9,10. Estudos in vitro têm demonstrado estatisticamente um maior desgaste significativo do dióxido de zircônia do que os pilares de titânio dentro do implante de titânio11. No entanto, a relevância clínica permanece incerta. Em nossa clínica, temos usado o pilar de dióxido de zircônia fabricado com Straumann® CARES® CADCAM desde 2009, em uma base diária nos casos estéticos com implantes no nível ósseo, e não tivemos problemas com fraturas do pilar até o momento. O correto modelo com CADCAM para um pilar de dióxido de zircônia e a qualidade e a precisão da peça de conexão no implante desempenham um papel crucial no sucesso de longo prazo. Ao focar no resultado de estudos histológicos, um estudo in vivo mostra que não houve diferenças visíveis na saúde dos tecidos moles na mucosa peri-implante adjacente às superfícies de pilares com titânio e dióxido de zircônia12. Outro estudo concluiu que o tecido mole em torno do dióxido de zircônia cicatriza mais rapidamente do que quando em contato com o titânio13. Uma revisão sistemática14, que avaliou a literatura existente sobre pilares de dióxido de zircônia, conclui com base em evidências de estudos histológicos em animais e humanos que o dióxido de zircônia é adequado como um material para pilares de implantes dentários assim como o titânio. Sobre o acúmulo de placa, o dióxido de zircônia parece ter uma menor tendência para formação de placa bacteriana ligada à superfície nos estágios iniciais, o que é vantajoso.
3. Conclusão e recomendação clínica
Seleção do pilar nos locais estéticos: Os pilares de implantes estão localizados em uma zona de transição onde eles estão em contato com o implante e com os tecidos peri-implante circundantes. Assim, a escolha do pilar é de grande importância, especialmente em uma região sensível como a zona estética. Para reconstruções únicas, os pilares de dióxido de zircônia são indicados, podendo ser padrão ou personalizado, dependendo da posição protética do implante. Para reconstruções de vários elementos, os pilares de dióxido de zircônia são recomendados para próteses fixas múltiplas cimentadas, e os pilares de titânio e ouro, para próteses fixas múltiplas aparafusadas. Seleção do pilar em locais posteriores: A indicação clínica de cada tipo de pilar de implante depende principalmente da posição protética do implante e se um ou vários elementos precisam ser substituídos. Os pilares padrão e Straumann® Variobase são os pilares de escolha nos locais posteriores, se a posição protética do implante for a ideal. Os pilares padrão angulares, pilares de titânio individualizados por CADCAM ou pilares fundidos em ouro são indicados nos casos em que o implante não está instalado em uma posição protética ideal. Nas reconstruções com vários elementos, os pilares de titânio padrão ou de ouro individualizados são os recomendados.
Relatório de caso clínico
Restauração de um espaço edêntulo único com uma coroa de implante aparafusada e toda em cerâmica em um local posterior, utilizando o Pilar Straumann® Variobase. Este caso foi tratado em uma abordagem multidisciplinar: Prof. Dr. med. dent. Daniel Buser (Cirurgia), Dra. med. dent. Julia-Gabriela Wittneben, (Protética), Thomas Furter, CDT (Laboratório).
Paciente: mulher saudável, não fumante, 43 anos. Situação: um único espaço edêntulo, região 46 (FDI). Um Implante Straumann® Soft Tissue Level Regular Neck com superfície Straumann® SLActive® foi instalado em uma posição tridimensional correta (Fig. 3). Moldagem com moldeira aberta e registro de mordida ocorreram oito semanas mais tarde. Radiografia periapical para avaliação da posição do coping de moldagem (Fig. 4). Fabricação e articulação do molde. Inserção do scanbody. O molde foi centralizado no escaner (Fig. 5). Registro da mordida com o scanbody no lugar (Fig. 6). Verificação da imagem digital e modificação manual, correspondência da oclusão da dentição oposta (Figs. 7, 8). Foi usado um Pilar Straumann® Variobase (Fig. 9). Uma coroa IPS e.max CAD de vitrocerâmica de dissilicato de titânio foi encomendada e entregue ao laboratório de prótese dentária em uma cor azulada (Fig. 10). A coroa foi cortada com uma broca de diamante e cristalizada em uma estufa. Caracterização e finalização da coroa, seguidas pela adição manual da cerâmica de revestimento (IPS e.max. Ceram) e a utilização de pasta de corante e glaze (IPS e.max Ceram Essences e FLUO). Diferentes ciclos de jatos. Cimentação da coroa no Pilar Straumann® Variobase com cimento adesivo (Multilink Hybrid Abutment Cement). O excesso de cimento foi removido e polido (Figs. 11, 12). A coroa definitiva foi experimentada intraoralmente e inserida com 35 Ncm dentro do implante (Figs. 13, 14). Avaliação da posição da coroa (Fig. 15). A oclusão foi ajustada e as instruções de higiene oral foram dadas ao paciente.
IPS e.max CAD, IPS e.max. Ceram, Essences e FLUO são marcas registradas de Ivoclar Vivadent, Schaan/ Liechtenstein.
