Selección de pilar y éxito a largo plazo
Julia-Gabriela Wittneben sobre la selección de pilar basado en la indicación
La selección del pilar de implante para cada caso de paciente individual es una parte importante de la fase de implante-tratamiento protésico. Los estudios clínicos a largo plazo sobre reconstrucciones implantosoportadas fijas demuestran pocas tasas de complicaciones técnicas en relación con el propio pilar [1]. En este artículo, Julia-Gabriela Wittneben trata los diferentes tipos de pilares para implantes, los diversos materiales para pilar y sus indicaciones clínicas. Aquí se muestra un caso clínico que presenta paso a paso el tratamiento de un único hueco edéntulo con corona de implante atornillada íntegramente de cerámica.
1. Tipos de pilares para implantes
Los pilares para implantes pueden ser estándar o personalizados (Fig. 2). El uso de un pilar estándar está indicado si el implante se coloca en una posición protésica casi ideal. Las ventajas de los pilares estándar son su rapidez dentro del tratamiento general y, por tanto, una reducción del tiempo de fabricación técnica. Las divergencias entre prótesis implantosoportadas de varias unidades se pueden corregir con pilares angulados estándar. En la zona estética, es importante que la altura de cuello de un pilar prefabricado no sea de 360 grados uniformes, ya que la posición interproximal del margen de la corona se colocaría submucosalmente demasiado lejos. Por tanto, el diseño ideal de un pilar estándar debe ser parecido a una preparación del diente, siguiendo el contorno del margen gingival2 (Fig. 1). Existen limitaciones clínicas respecto a la posición del implante en una dimensión vertical. Si el implante se coloca demasiado apicalmente, los pilares estándar no están indicados, especialmente para reconstrucciones atornilladas, ya que no proporcionan el soporte suficiente para la cerámica de revestimiento.
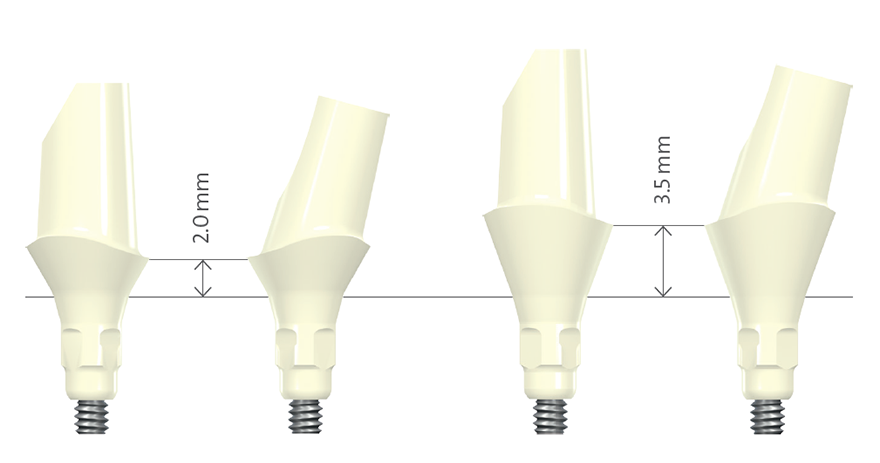
Fig. 1: Pilares estándar fabricados en dióxido de circonio
Personalizar un pilar proporciona al médico la libertad de adaptar su posición y su angulación. En el caso de un implante a nivel óseo, también se puede adaptar el perfil de emergencia y la futura posición del margen de la corona de la restauración final. Esto permite diseñar los pilares para que ofrezcan un soporte óptimo para el material de revestimiento cerámico, en especial para reconstrucciones atornilladas. La adaptación se puede lograr con tecnología CADCAM, pilares de oro producidos con métodos de moldeo a la cera perdida tradicionales o pilares con base de titanio (Fig. 2). Los pilares personalizados fabricados mediante CADCAM se pueden fabricar en titanio o dióxido de circonio para implantes a nivel óseo (Bone Level) y a nivel de tejido (Tissue Level). Se pueden utilizar para coronas individuales atornilladas o de cemento o para puentes cementados. La ventaja del pilar CADCAM es la posibilidad de usar material cerámico de alto rendimiento que de nuevo ofrece muchos beneficios, en especial, en lugares estéticos. En pacientes con un biotipo de tejido fino, no se verá ningún brillo grisáceo con un pilar de color blanco. No obstante, también se puede elegir como material el titanio. Otra ventaja es la adaptación respecto a la angulación y el diseño del pilar para soportar la cerámica de revestimiento.
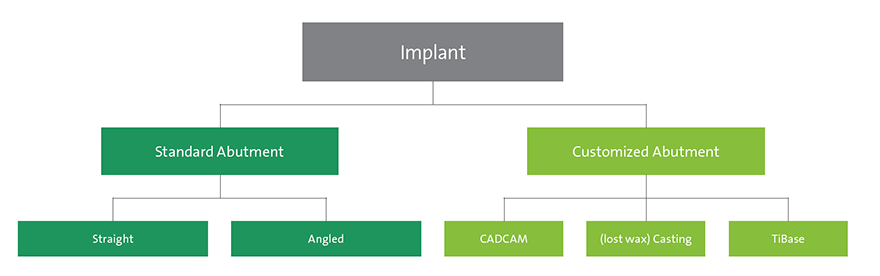
Fig. 2: Árbol de decisión del pilar
Los pilares de oro de fundido tradicional se pueden utilizar para puentes y coronas individuales atornillados o cementados, y están disponibles para implantes colocados a nivel de tejido blando o a nivel óseo. Su ventaja consiste en facilitar el atornillado con puentes. El embargo, es inconveniente, sin que los pilares de oro son sensibles a la técnica, requieren más tiempo y generan mayores costes de fabricación. Un estudio histológico en vivo realizado en perros ha demostrado que las aleaciones de oro también tienen inconvenientes desde el punto de vista de la integración del tejido blando. Histológicamente, se ha demostrado un eje apical del epitelio de barrera y el hueso marginal alrededor de los pilares de aleación de oro3. El tercer grupo de pilares personalizados en implantes son los pilares con base de titanio. Existen pilares de dos piezas con base de titanio. A los médicos les preocupa a veces cómo tratar las complicaciones con un pilar íntegramente de cerámica derivados de la recuperación de fragmentos de cerámica rotos en el implante, algo que puede resultar difícil. La principal ventaja de este tipo de pilar es que no hay material de cerámica dentro de la conexión del implante de titanio. No obstante, su inconveniente reside en la falta de pruebas entre los datos clínicos publicados hasta la fecha. En concreto, sigue sin conocerse la reacción del tejido blando con respecto al espacio de fijación, en especial, en casos de implante a nivel óseo en la zona estética. En consecuencia, este tipo de pilar debe usarse teniendo en cuenta esta limitación actual 4. No obstante, el uso en implantes a nivel de tejido blando de un microespacio sobre el nivel óseo no sería tan preocupante. Un ejemplo de caso de implante a nivel de tejido blando se ofrece paso a paso en las siguientes páginas (Fig. 3-15).
2. Material de pilares para implantes
Para los pilares para implantes existen diferentes biomateriales. El PMMA (polimetilmetacrilato), el titanio y el PEEK (polietercetonacetona) están indicados para pilares que soporten provisionales, especialmente para implantes de nivel óseo, con el fin de personalizar el perfil de emergencia e individualizar la mucosa periimplantaria con acondicionamiento de tejido blando5. Los materiales seleccionados para los pilares de las restauraciones finales son el titanio, el oro, el dióxido de circonio y la cerámica a base de óxido de aluminio. El titanio y el dióxido de circonio se tratarán en este artículo en relación con los resultados clínicos e histológicos. El titanio es el biomaterial de elección para obtener un contrastado buen comportamiento y una larga duración bajo carga funcional tanto para tejido blando como para tejido duro. Tiene excelente biocompatibilidad, fuerza mecánica y es resistente a la corrosión. Por lo tanto, se trata del material de pilar preferido para lugares posteriores. Sin embargo, las expectativas de los pacientes en la zona anterior están aumentando. En lugares estéticos, el espesor de la mucosa desempeña un papel importante. Un estudio con animales que comparaba diferentes materiales dentales bajo diferentes espesores de la mucosa mostró que el titanio inducía el cambio de color más notorio. El dióxido de circonio no inducía cambios de color visibles en 2 y 3 mm de mucosa gruesa.6 Con la información de las pruebas médicas y las revisiones sistemáticas disponibles, no se han encontrado diferencias entre los pilares de dióxido de circonio y los metálicos según aspectos estéticos, técnicos y biológicos en resultados clínicos7,8,9,10. En estudios in vitro se ha constatado un desgaste estadísticamente mucho mayor de los pilares de dióxido de circonio que de los pilares de titanio dentro de implantes de titanio11. No obstante, su relevancia clínica sigue sin estar clara. En nuestra clínica, hemos estado usando pilares de dióxido de circonio fabricados en CADCAM Straumann® CARES® desde 2009 diariamente en casos estéticos con implantes a nivel óseo y hasta ahora no hemos tenido problemas con fracturas de pilares. El diseño CADCAM correcto de un pilar de dióxido de circonio y la calidad y la precisión de la pieza conectora con el implante desempeñan un papel fundamental en el éxito a largo plazo. Centrándonos en el resultado de los estudios histológicos, un estudio in vivo demuestra que no existen diferencias visibles en la salud del tejido blando en la mucosa periimplantaria adyacente a las superficies de los pilares de dióxido de circonio y de titanio12. Otro estudio encontró que el tejido blando alrededor del dióxido de circonio cicatrizaba más rápido cuando estaba en contacto con titanio13. Una revisión sistemática14que evaluaba la literatura existente sobre pilares de dióxido de circonio concluyó, en función de las pruebas de estudios histológicos en animales y humanos, que el dióxido de circonio es un material tan adecuado para los pilares de implantes dentales como el titanio. Respecto a la acumulación de placa, en las primeras fases el dióxido de circonio parece tener una tendencia menor a la placa bacteriana ligada a la superficie, lo cual resulta ventajoso.
3. Conclusión y recomendación clínica
Selección de pilares en lugares estéticos: Los pilares de implantes se encuentran en una zona de transición donde están en contacto con el implante y con los tejidos periimplantarios que lo rodean. Por lo tanto, la elección del pilar es de vital importancia, especialmente en una región sensible como la zona estética. En reconstrucciones de una sola unidad, están indicados pilares de dióxido de circonio, que pueden ser estándar o personalizados en función de la posición protésica del implante. En reconstrucciones de varias unidades, los pilares de dióxido de circonio están recomendados para puentes cementados y los pilares de titanio para puentes atornillados. Selección de pilares en lugares posteriores: la indicación clínica para cada tipo de pilar de implante depende principalmente de la posición protésica del implante y de si debe reemplazarse una sola pieza o varias. Los pilares estándar y los pilares Straumann® Variobase son el pilar elegido en lugares posteriores si la posición protésica del implante es ideal. Los pilares angulados estándar, los pilares CADCAM individualizados fabricados en titanio o los pilares fundidos en oro están indicados en casos en los que el implante no se coloque en una posición protésica ideal. En reconstrucciones de varias piezas se recomiendan pilares de oro individualizados o de titanio estándar.
Informe de caso clínico
Restauración de un hueco edéntulo con una corona de implante atornillada íntegramente en cerámica en un lugar posterior mediante el pilar Straumann® Variobase. Este caso se trató con un enfoque multidisciplinar: Prof. Dr. med. dent. Daniel Buser (Cirugía), Dr. med. dent. Julia-Gabriela Wittneben (Prótesis), Thomas Furter CDT (Laboratorio).
Paciente: mujer sana de 43 años, no fumadora. Situación: un unitario edéntulo, región 46 (FDI). Se colocó un implante Straumann® Soft Tissue Level Regular Neck con superficie Straumann® SLActive® en una posición tridimensional correcta (Fig. 3). Ocho semanas después, se realizaron la impresión de cubeta abierta y el registro oclusal. Radiografía periapical para evaluación de la posición del casquillo de impresión (Fig. 4). Fabricación y articulación de los modelos maestro. Inserción del cuerpo de referencia. El modelo se centralizó en la máquina de escaneo (Fig. 5). Registro oclusal con el cuerpo de referencia en su sitio (Fig. 6). Verificación de imagen digital y modificación manual, oclusión coincidente de los dientes antagonistas (Fig. 7, 8). Se utilizó un pilar Straumann® Variobase (Fig. 9). Se encargó una corona IPS e.max CAD de cerámica vítrea de disilicato de litio y se entregó al laboratorio dental en un color azulado (Fig. 10). La corona se cortó con una fresa de diamante y se cristalizó en un horno. A la caracterización y finalización de la corona siguió el añadido manual de cerámica de revestimiento (IPS e.max. Ceram) y el uso de cola de tinción y glaseado (IPS e.max Ceram Essences y FLUO). Diferentes ciclos de cocción Cimentación de la corona en el pilar Straumann® Variobase con cemento adhesivo (cemento de pilar híbrido Multilink). El exceso de cemento se retiró y se pulió (Fig. 11, 12). La corona final se probó intraoralmente y se insertó con 35 Ncm dentro del implante (Fig. 13, 14). Evaluación de la posición de la corona (Fig. 15). La oclusión se ajustó y se dieron al paciente instrucciones de higiene bucal.
IPS e.max CAD, IPS e.max. Ceram, Essences y FLUO son marcas comerciales registradas de Ivoclar Vivadent, Schaan/Liechtenstein.


