Aumento del tejido blando con botiss mucoderm®
Conclusiones de la 1ª Reunión internacional de expertos en Hamburgo (Alemania) en noviembre de 2016
Con motivo del encuentro anual de la Sociedad Alemana de Implantología (DGI) celebrado en Hamburgo el 26 de noviembre de 2016, siete destacados expertos con grandes conocimientos tanto científicos como clínicos en el ámbito de la reconstrucción del tejido blando se reunieron para analizar la situación actual del tratamiento del tejido blando periimplantario y periodontal. El debate se centró especialmente en la aplicación y la experiencia clínica con la matriz de colágeno llamada mucoderm®, los datos publicados y los datos en preparación, así como las limitaciones potenciales de su uso, lo que incluía la comparación con injertos de tejido propio.
Se han debatido todos los ámbitos de tratamiento en el tejido blando, como la cobertura de recesión en los dientes, el engrosamiento del tejido blando periimplantario, la ampliación de la mucosa adherida y el tratamiento alveolar. A la reunión se invitó a los siguientes expertos: Prof. Dr. Dr. Adrian Kasaj (Universidad de Mainz, Alemania), PD Dr. Dr. Peer Kämmerer (Centro Médico Universitario Rostock, Alemania), Dr. Raluca Cosgarea (Universidad de Cluij-Napocca, Rumanía, y Universidad de Marburg, Alemania), Dr. Dominiki Chazopoulou (Universidad Queen Mary de Londres, RU), Dr. Attila Horváth (Universidad Semmelweis de Budapest, Hungría), Dr. Alessandro Rossi (Universidad de Milán, Italia) y Dr. Christian Schmitt (Universidad de Erlangen, Alemania).
mucoderm®: matriz dérmica acelular diseñada para la reconstrucción del tejido blando
mucoderm® es una matriz de colágeno tipo I/III natural derivada de dermis porcina que se somete a un proceso de purificación en varias fases para eliminar todas las células y proteínas no colagenosas, así como las bacterias y los virus potenciales. Este procedimiento produce una matriz estable tridimensional compuesta de una red de colágeno abierta, porosa y reticulada que sirve como estructura para la adhesión y la migración de vasos sanguíneos y células de tejido conjuntivo (Pabst et al. 2015, Pabst et al. 2014). mucoderm® se asemeja a la dermis humana y se revasculariza de forma eficaz tras la implantación y posteriormente se remodela paulatinamente en el propio tejido conjuntivo del paciente (Barbeck et al. 2015, Rothamel et al. 2014, Ramachandra et al. 2014). Atraídos por las señales de las células endoteliales en migración y proliferación activadas, los vasos sanguíneos de los tejidos circundantes crecen entonces en la matriz. Al mismo tiempo, los fibroblastos se adhieren y se extienden por la matriz. La degradación simultánea de mucoderm® y la producción de colágeno de los fibroblastos de adhesión conduce a su completa sustitución por el tejido conjuntivo huésped en aproximadamente 6-9 meses (Rothamel et al. 2014). Por lo tanto, mucoderm® favorece la revascularización, la integración rápida del tejido blando y ofrece una alternativa segura al tejido conjuntivo propio. Es apropiado para una variada gama de indicaciones de injerto de tejido blando como, por ejemplo, el tratamiento de defectos de recesión, el engrosamiento del tejido blando periimplantario y la vestibuloplastia (Schmitt et al. 2016, Zafiropoulos et al. 2016, Rossi et al. 2016, Konstantinova et al. 2015, Stricker et al. 2014).
Tratamiento de recesiones gingivales
Las recesiones gingivales están asociadas a una alta prevalencia de defectos en el tejido blando, que pueden manifestarse como raíces dentales hipersensibles o caries radiculares (Sarfati et al. 2010). Los procedimientos de cobertura radicular están mayoritariamente indicados para mejorar la morfología del tejido, facilitar la limpieza oral de los dientes afectados y mejorar el resultado estético, disminuyendo así el riesgo de una posterior pérdida de fijación.
Estudios recientemente publicados sobre el tratamiento de recesiones de Miller de clase I y II maxilares utilizando la técnica modificada del túnel avanzado coronalmente (MCAT) en conjunto con la matriz de colágeno, sugieren que mucoderm® es una alternativa válida para el injerto de tejido conjuntivo subepitelial (SCTG) propio (Cieslik-Wegemund et al. 2016, Cosgarea et al. 2016). Se han observado valores promedio de cobertura de la raíz del 73,2% transcurridos 12 meses (Cosgarea et al. 2016) y de cicatrización del 91% transcurridos 6 meses (Cieslik-Wegemund et al. 2016). También se ha observado una mejora y un tratamiento correctos de las recesiones de Miller de clase III con el uso de mucoderm® (Cosgarea et al. 2016). El resultado clínico de Miller de clase III es, no obstante, menos predecible en comparación con los resultados de las recesiones de Miller de clase I y II. Los expertos coincidieron en que las recesiones mandibulares se pueden tratar con mucoderm® y la técnica del túnel, aunque el procedimiento quirúrgico es más sensible a la técnica y los resultados en la mandíbula pueden ser menos predecibles si se los compara con el maxilar; además, la inserción en músculos y frénulos puede afectar negativamente a los resultados. En tales casos, el uso de mucoderm® solo debería plantearse si se puede lograr una sutura sin tensión del colgajo que cubre el injerto. Además, se podría considerar el uso complementario de Emdogain®.
Factores relacionados con defectos y con el paciente que afectan a un resultado satisfactorio de la cobertura de recesión
Los expertos acordaron que (i) la cobertura de la matriz, (ii) el diseño del colgajo, (iii) el biotipo gingival y (iv) la inmovilización de la matriz, son factores clave para obtener un resultado estable y predecible cuando se utiliza mucoderm® en cirugía plástica periodontal.
(i) Cobertura de la matriz y (ii) diseño del colgajo
La técnica de colgajo óptima no depende del material de injerto utilizado sino, más bien, de la situación anatómica y de la evaluación cuidadosa del lugar (biotipo, ancho y cantidad de tejido queratinizado presente y clasificación de la recesión). El grupo de expertos acordó que una vascularización suficiente del colgajo es extremadamente importante. La revascularización depende enormemente del grosor del tejido blando, del diseño del colgajo y de la fijación del colgajo. La elección de la técnica de colgajo debería basarse en el objetivo de mantener la vascularización del colgajo superpuesto, que nutrirá a la matriz subyacente. En el caso de un vestíbulo poco profundo, se puede preferir la técnica modificada de colgajo avanzado coronalmente (MCAF). Si se emplea la técnica de colgajo avanzado coronalmente (CAF) o la MCAF, debe realizarse una preparación del colgajo parcial/completo. Curiosamente, una comparación de las dos técnicas de colgajo en conjunto con mucoderm® reveló resultados superiores para la MCAF respecto a la estética y a la satisfacción del paciente, aunque ambos diseños de colgajo dieron como resultado una cobertura radicular satisfactoria (Ahmedbeyli et al. 2015). El Prof. Kasaj hizo hincapié en que una sutura sin tensión del colgajo mediante un colgajo de grosor parcial o completo sobre el injerto resulta de máxima importancia a la hora de mantener un aporte vascular adecuado para la matriz.
(iii) Biotipo gingival
Con respecto a la técnica de colgajo indicada, la evaluación del biotipo gingival es igualmente fundamental para obtener un resultado del tratamiento satisfactorio, ya que el colgajo superpuesto debe ser lo suficientemente grueso como para permitir el aporte de sangre. Un biotipo delgado en la mandíbula requiere de una técnica que sea sensible y exigente debido al riesgo de aporte de sangre inadecuado y a la dificultad de conseguir una sutura sin tensión. Sin embargo, un biotipo delgado per se no presenta contraindicación para el uso de mucoderm®, aunque el procedimiento quirúrgico es más exigente y debería preferirse una técnica que emplee un colgajo de grosor completo. En el caso de un biotipo delgado, se puede preferir la técnica del túnel (MCAT), ya que no requiere la escisión del colgajo y mucoderm® se puede colocar en contacto directo con el hueso.
(iv) Inmovilización de la matriz
La inmovilización del injerto mucoderm® es otro punto crucial a la hora de favorecer la integración de la matriz. Si mucoderm® no está lo suficientemente estabilizado por el colgajo, la matriz debe fijarse/suturarse para evitar micromovimientos durante el período de cicatrización inicial. El grupo de expertos destacó que la necesidad de fijar la matriz de colágeno depende de la técnica de colgajo empleada. Si es posible, mucoderm® debe suturarse bien al periostio (CAF o MCAF) para evitar la formación de un hematoma. Si mucoderm® no se puede fijar al periostio, se debe fijar al colgajo. Si se utiliza la técnica del túnel, mucoderm® debe fijarse a las caras internas del colgajo.
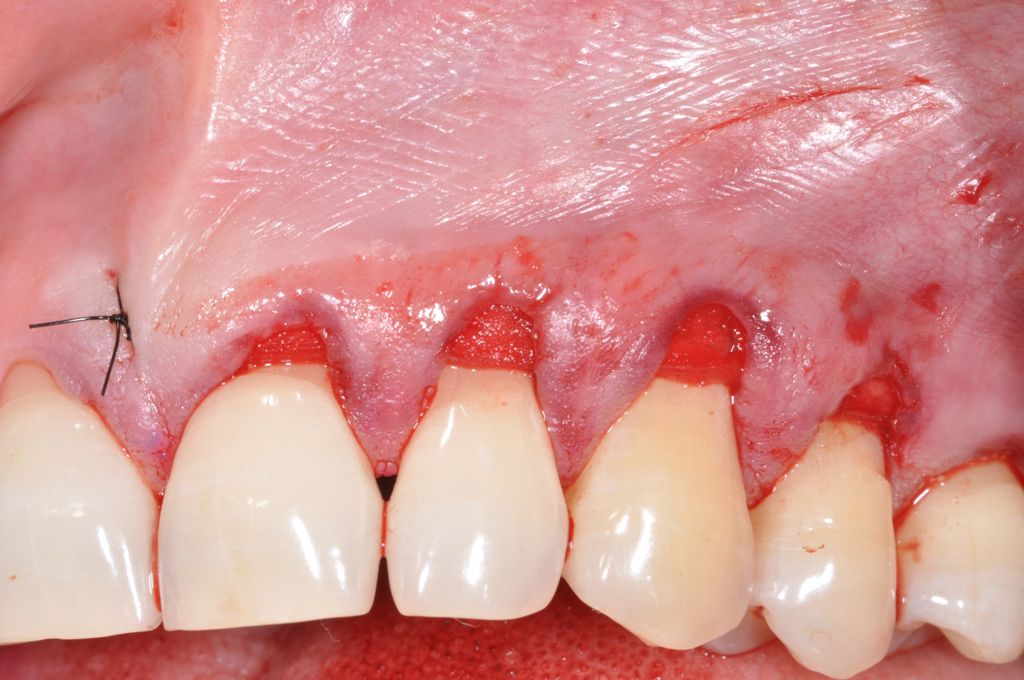
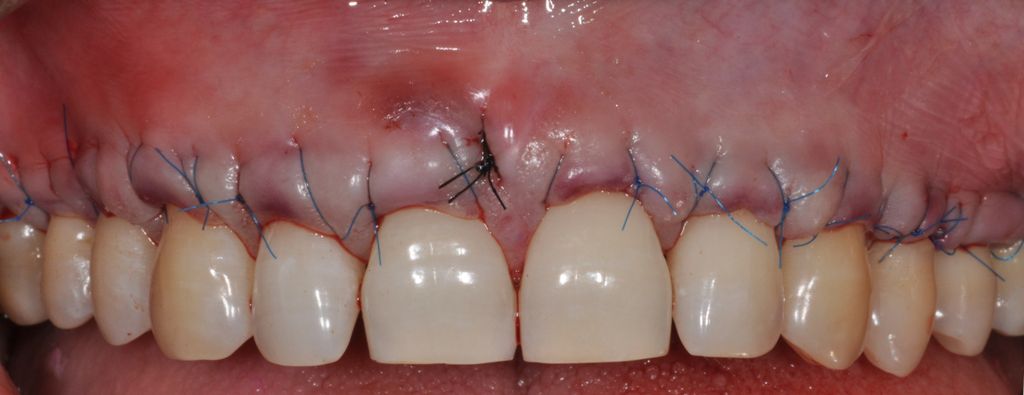
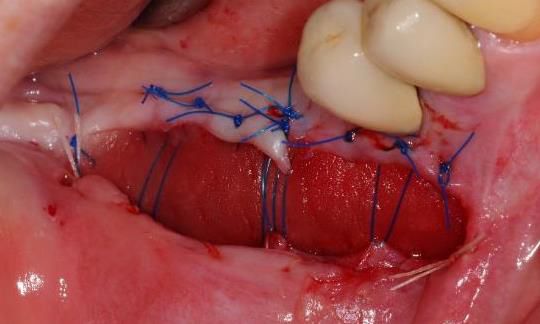
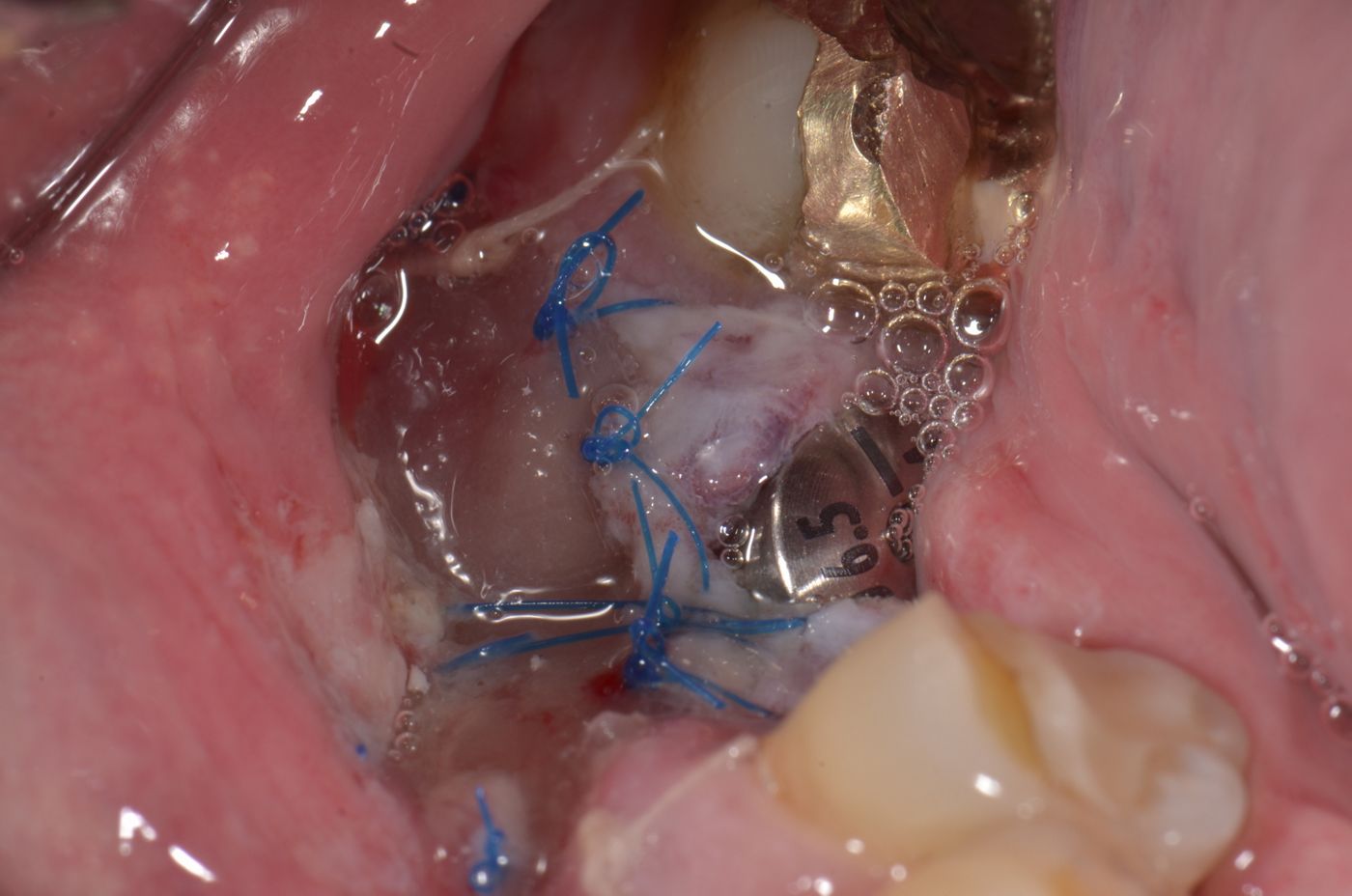
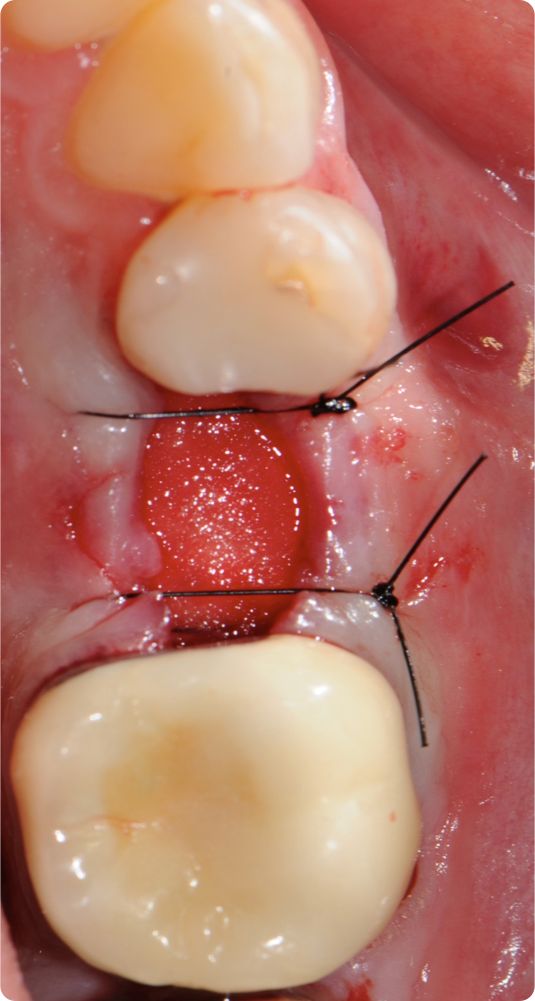
Una adaptación de plano en el lugar receptor resulta básica. El Dr. Cosgarea y el Dr. Horváth se refirieron a la fijación mediante suturas suspensorias cuando se utilizan procedimientos MCAT; por ejemplo, los extremos laterales de mucoderm® se pueden suturar al colgajo o al periostio, mientras que las piezas coronales se fijan mejor con suturas suspensorias alrededor de los dientes o las férulas (Fig. 1 y 2). Para CAF o MCAF, se pueden usar suturas cruzadas para la adaptación de plano del injerto sobre toda la zona (Fig. 3).
Factores de éxito relacionados con el paciente
Más factores que afectan al éxito clínico son las puntuaciones de placa bajas preoperatorias y un buen control de la placa, así como una adecuada preparación prequirúrgica de las superficies radiculares expuestas para eliminar la inflamación y eliminar factores locales, incluidas la placa y las tinciones. Puede que sea recomendable alguna modificación de la superficie radicular y deberán eliminarse restauraciones de resina polimerizada. Además, es extremadamente importante el cuidado del paciente, y deben darse recomendaciones para el cuidado posoperatorio, como evitar el cepillado y el uso de hilo dental, así como traumatismos mecánicos, en los lugares de la cirugía durante un período de 2 a 3 semanas, el enjuague diario con clorhexidina al 0,1-0,2% o la aplicación de gel de clorhexidina antiséptico durante un período de 2 a 3 semanas, la prescripción de fármacos antiinflamatorios y de fármacos para el control del dolor. Se recomienda la extracción de la sutura entre la segunda y la cuarta semana tras la cirugía.
Cicatrización y estabilidad a largo plazo de mucoderm®
Observaciones y datos recientemente publicados hacen referencia al patrón de cicatrización y a la estabilidad a largo plazo específicos de los resultados clínicos. En la primera fase de cicatrización, puede observarse tejido abultado o "bordes" en la zona coronaria de la matriz, pero irán desapareciendo gradualmente. El resultado estético mejorará con el tiempo y se podrá observar la nivelación del tejido junto con una sustitución progresiva. También se ha observado que el tratamiento con mucoderm® no comportará ningún aumento, o solo un aumento mínimo, del ancho del tejido queratinizado. Sin embargo, el tratamiento provocará un aumento del grosor del tejido y un tejido conjuntivo denso debajo de la superficie mucosa, lo que ayudará a estabilizar el periodonto. El resultado general es bueno, aunque la superficie no esté ampliamente queratinizada. Por otro lado, la queratinización del tejido no es básica para obtener un resultado de tratamiento satisfactorio, considerando que una banda de la encía fijada idealmente en 2 mm es esencial para el mantenimiento de la salud periodontal y para permitir a los pacientes mantener una buena higiene bucal (Marquez et al. 2004).
La estabilidad de los resultados clínicos cuando se utiliza mucoderm para tratar recesiones gingivales está siendo actualmente investigada mediante un análisis retrospectivo (Gaal, Hangyasi et al., inédito). En este estudio se han examinado 198 defectos con un período de seguimiento medio de 28 meses, y los resultados preliminares indican que mucoderm® es una alternativa adecuada al SCTG propio. Se están preparando los resultados para su publicación y hay previsto un seguimiento a largo plazo de los pacientes. Otro análisis retrospectivo de 12 pacientes con 54 recesiones aporta datos de 3 años sobre la técnica MCAT en conjunto con mucoderm® (Cosgarea, Sculean et al., en preparación). Los resultados clínicos indican resultados estables a lo largo del tiempo; su publicación está prevista para 2017. Además, los casos clínicos con períodos de seguimiento de hasta 5 años demuestran resultados muy estables, aunque se necesitan más estudios de confirmación a largo plazo.
Decidir entre mucoderm® y SCTG
Los expertos llegaron a la conclusión de que mucoderm® puede ser una auténtica alternativa a SCTG y, en determinadas situaciones clínicas, el uso de mucoderm® es especialmente beneficioso. En el caso de recesiones múltiples a veces no es posible extraer injertos propio en la cantidad o de la calidad suficiente, lo que exige un sustituto de tejido blando como, por ejemplo, mucoderm®, que ofrece una disponibilidad ilimitada. Mediante el uso de una matriz dérmica, se pueden tratar múltiples recesiones en una sola sesión. Además, mucoderm® ofrece la ventaja de menos intervenciones quirúrgicas y complicaciones postoperatorias, ya que no es necesaria la recogida de tejido del paladar, lo cual reduce el tiempo de cirugía. El tratamiento también es menos doloroso si se utiliza la matriz de colágeno en lugar de un autoinjerto, ya que los pacientes se quejan sobre todo de dolor en la zona donante. mucoderm® también puede ser la opción preferible en pacientes con ansiedad al ser la cirugía más complicada y lenta si debe recogerse un SCTG. Se señaló que, si la situación permite tanto el autoinjerto como mucoderm®, se debe preguntar al paciente su preferencia, aspecto este que debe considerarse como el más importante en el contexto de la clínica privada. En comparación con el SCTG, mucoderm® debe cubrirse, lo que significa que el reposicionamiento coronal del colgajo puede producir la uniformización del vestíbulo en determinadas situaciones. El injerto de tejido blando propio también debe considerarse el mejor método en caso de recesiones mandibulares de la zona frontal en combinación con un biotipo delgado.
Combinación de mucoderm® y derivado de la matriz del esmalte: un novedoso enfoque a la cobertura de recesión
Un nuevo y atractivo enfoque a la hora de tratar las recesiones gingivales es la combinación de mucoderm® y derivado de la matriz del esmalte (EMD, Straumann® Emdogain®), lo cual puede mejorar los resultados clínicos y la cicatrización postoperatoria (Kasaj et al. 2015). Hallazgos recientes indican que los productos de colágeno pueden absorber y liberar la actividad biológica de las proteínas de la matriz del esmalte favoreciendo la regeneración (Miron et al. 2016, Stähli et al. 2016, Shirakata et al. 2016). Un reciente estudio in vivo demostró el uso combinado de mucoderm® y EMD para la cobertura de recesión empleada con la técnica CAF. La mayoría de los parámetros clínicos como, por ejemplo, la ganancia ósea y la formación de cemento, favorecían el grupo de matriz de colágeno/EMD (Shirakata et al. 2016). La incorporación de Straumann® Emdogain® a un procedimiento de cobertura de raíz con mucoderm® puede, por tanto, mejorar la calidad de la fijación (Shirakata et al. 2016, McGuire et al. 2003) y estimular la angiogénesis (Kasaj et al. 2012), lo cual puede aumentar la revascularización y la integración de la matriz de colágeno. Además, la combinación de Emdogain® con mucoderm® puede mejorar la cantidad de tejido queratinizado (Shin et al. 2007, Pilloni et al. 2006), lo cual puede ser beneficioso en caso de encía queratinizada residual menor o nula. Emdogain® puede, por lo tanto, suponer una ventaja en biotipos gingivales delgados para mejorar la vascularización del colgajo y, con ello, la integración de mucoderm® y la remodelación del tejido. Los expertos están ampliamente de acuerdo en que se puede lograr una auténtica regeneración periodóntica combinando mucoderm® con Emdogain®. El Dr. Chatzopoulou y el Prof. Kasaj destacaron que esta combinación era especialmente beneficiosa para fumadores y otros grupos con problemas médicos (p. ej. pacientes diabéticos), ya que se ha demostrado que Emdogain® es capaz de favorecer la cicatrización de las heridas (Alves et al. 2012). La incorporación de Emdogain® también podría mejorar los resultados clínicos en defectos tipo recesión de Miller de clase III (Shin et al. 2007, Cueva et al. 2004), aunque la cobertura de la raíz completa es menos predecible en esta indicación. Respecto al procedimiento correcto, el grupo de expertos señaló que el gel Emdogain® debe aplicarse por debajo y por encima de mucoderm®. La experiencia clínica también ha demostrado que Emdogain® mejora la cicatrización de las heridas y es más cómodo para el paciente.
En resumen, la matriz mucoderm® puede ser una alternativa válida al injerto de tejido blando en el caso de la cobertura de recesión. Para obtener unos resultados médicos satisfactorios, la selección correcta del paciente en función de la clase de Miller es obligatoria, así como una técnica quirúrgica que permita una revascularización eficaz y una cobertura completa de la matriz. El uso combinado de mucoderm® y Emdogain® en esta indicación puede ser un enfoque atractivo para inducir la formación de una fijación natural, ganar nuevo volumen de tejido blando y, al mismo tiempo, mejorar la cicatrización postoperatoria.
Engrosamiento del tejido blando alrededor de dientes e implantes
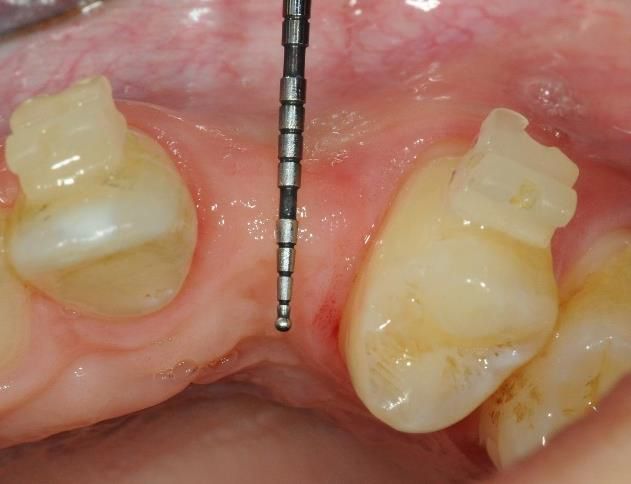
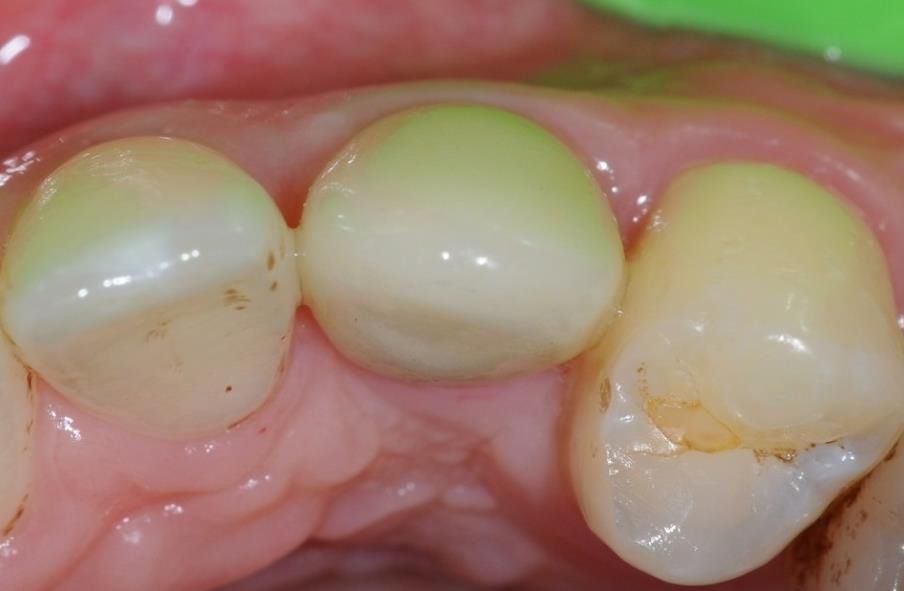
Disponer de suficiente tejido blando periimplantario es crucial para evitar la pérdida ósea crestal posterior a la colocación del implante, tal como indican recientes estudios (Akcali et al. 2016, Linkevicius et al. 2009). mucoderm® está indicado para aumentar el tejido blando alrededor de dientes e implantes dentales (Zafiropoulos et al. 2016, Puisys et al. 2015, Schmitt et al. 2015).
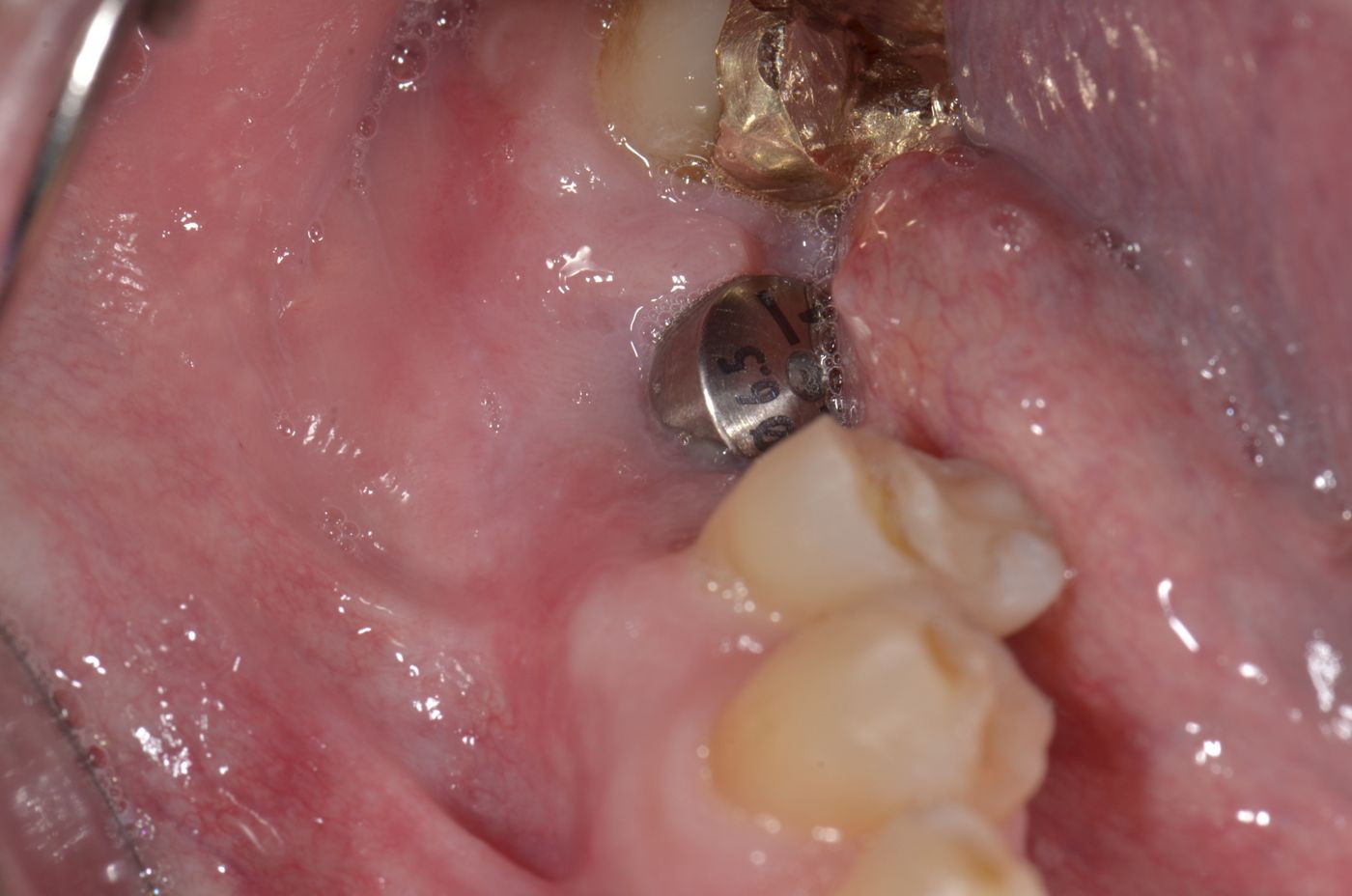
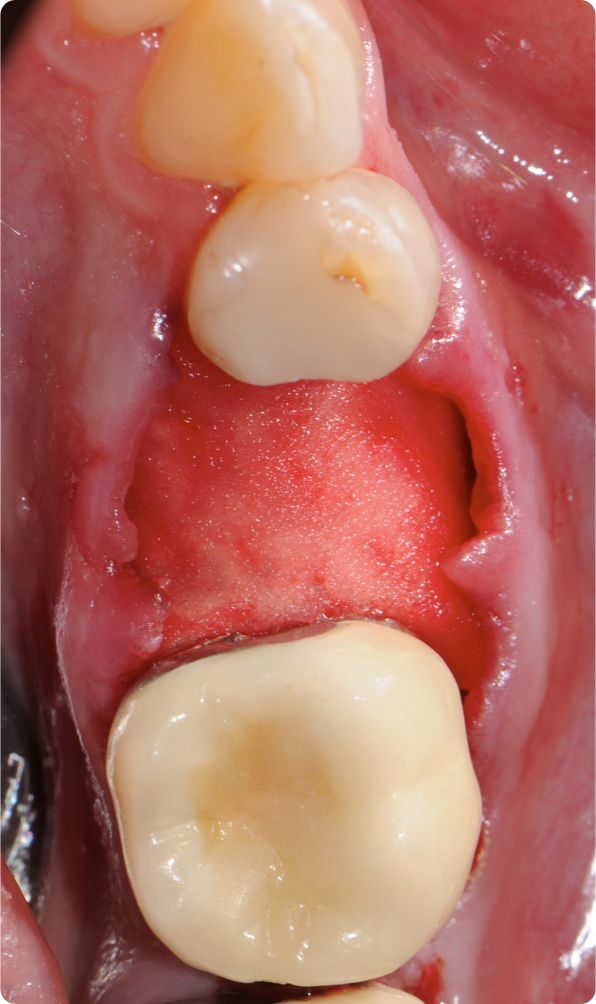
Datos in vivo actuales destacan la estabilidad de volumen de la matriz mucoderm® en procedimientos de engrosamiento del tejido. Se ha observado pérdida de volumen en los 3 primeros meses tras el engrosamiento del tejido alrededor de los dientes de un modelo animal al comparar mucoderm® con un SCTG palatal (Schmitt et al. 2015). Esto está en consonancia con diversos casos operados por los expertos en los que se observó una pérdida de volumen de aproximadamente el 50% en los 3 primeros meses. Transcurridos 3 meses, en el estudio con animales se observó una estabilización con iguales resultados hasta los 10 meses (Schmitt et al. 2015). Análisis histológicos cuantitativos tras el engrosamiento del tejido con mucoderm® frente a SCTG han demostrado un engrosamiento de tejido considerablemente mayor en el grupo de SCTG después de 10 meses (Schmitt et al., inédito). Curiosamente, la cuantificación inmunohistológica del colágeno de proteínas de la matriz y VEGF no mostró diferencias significativas entre los grupos de mucoderm® y de SCTG después de 10 meses en las regiones aumentadas (Schmitt et al., inédito).
Los resultados preliminares de un ensayo clínico en curso muestran pérdidas de volumen del 84% para mucoderm® y del 53% para SCTG tras el engrosamiento del tejido alrededor de los implantes dentales después de un período de evaluación de 6 meses (Schmitt et al., inédito). No obstante, el tratamiento produjo aumentos comparables en el engrosamiento del tejido después de los 6 meses (aproximadamente 1,5 mm para mucoderm® y 1,46 mm para el SCTG). Estos resultados están en consonancia con diversos casos y estudios que muestran un promedio de ganancia de tejido blando de aproximadamente 1,0-1,5 mm pasados entre 6 y 10 meses tras el aumento de tejido (Zafiropoulos et al. 2016, Schmitt et al., inédito, Rossi et al., inédito). En relación con el engrosamiento del tejido blando, también se demostró que la matriz de colágeno puede mejorar el resultado estético en procedimientos de colocación temprana de implantes (Puisys et al. 2015). El grupo de expertos afirmó que una ganancia de grosor del tejido blando de aproximadamente 1,0-1,5 mm se puede considerar un resultado clínico satisfactorio y que el sobrecontorno podría ser útil a la hora de explicar la pérdida de volumen.
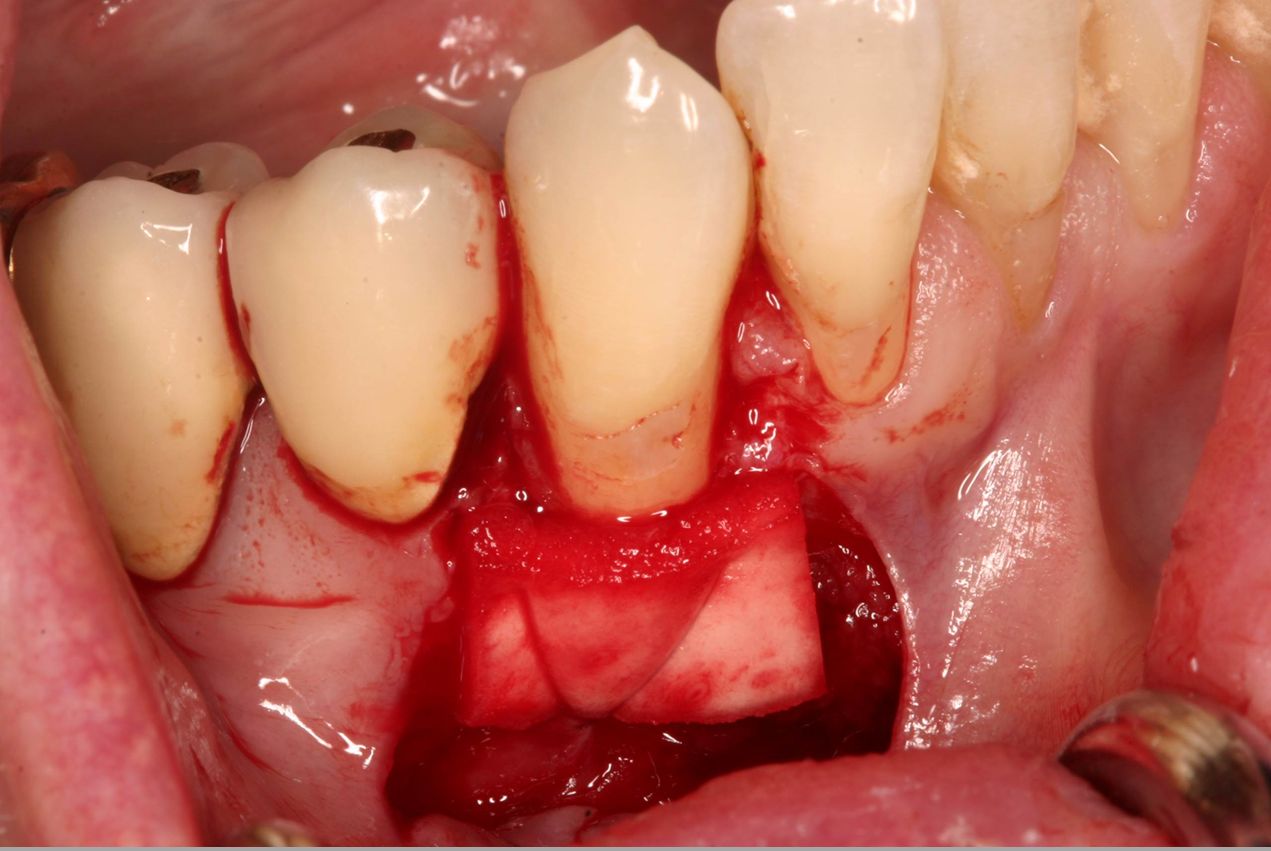
En conclusión, el engrosamiento de los tejidos blandos alrededor de implantes o dientes naturales puede lograrse aplicando mucoderm® en lugar de un autoinjerto, aunque la pérdida de volumen en la primera fase parece ser más pronunciada en comparación con el injerto de tejido blando propio (Fig. 4-7). No obstante, un estudio publicado recientemente (Zafiropoulos et al. 2016) y los resultados preliminares de estudios clínicos en curso indican una ganancia de volumen de tejido blando comparable tras el aumento con mucoderm®. En particular, en un estudio retrospectivo se demostró la estabilidad de los resultados clínicos hasta al menos 5 años después del engrosamiento del tejido blando (Puisys et al. 2015).
Vestibuloplastia
Un ancho correcto de la mucosa adherida alrededor de dientes e implantes ofrece protección frente a la penetración de microorganismos y partículas de alimentos. La encía fijada absorbe la tensión mecánica del labio y los músculos de las mejillas, protegiendo los dientes de dicha tensión. Una reducción de la encía fijada, o su ausencia, puede aumentar la susceptibilidad a la recesión y la inflamación (periodontitis o periimplantitis), lo que conduce potencialmente a una resorción ósea y a la pérdida del diente o el implante, respectivamente (Bassetti et al. 2015). Los expertos están ampliamente de acuerdo en que menos de 2 mm de tejido queratinizado alrededor de un diente o un implante puede causar molestias al cepillarse, conduciendo potencialmente a una higiene bucal deficiente, a la acumulación de placa y a la inflamación (Lin et al. 2013).
mucoderm® está indicado para aumentar la encía fijada en procedimientos de vestibuloplastia (Hegedüs et al. 2015, Konstantinova et al. 2015, Soytürk et al. 2015, Horvath et al. 2014, Nocini et al. 2014). En esta indicación es necesario un estrecho contacto entre el periostio y mucoderm® para garantizar una integración y una revitalización rápidas de la matriz mediante el crecimiento interno de los vasos sanguíneos y las células. mucoderm® debe fijarse bien al periostio subyacente mediante suturas de colchonero periósticas modificadas para alcanzar un contacto ajustado entre el injerto y el periostio (Fig. 8). Además, puede ser beneficioso tratar de insertar la matriz bajo la mucosa queratinizada restante. Se puede aplicar una sutura suspensoria continua para fijar la mucosa móvil.
Estudios en curso están investigando la cicatrización y la estabilidad de volumen de la matriz de colágeno en procedimientos de vestibuloplastia (Horváth et al., Kämmerer et al., inédito). El Dr. Horváth informó de una rápida vascularización en la primera fase de cicatrización que, en muchos casos, parece ser incluso más rápida que la revitalización del injerto gingival libre (FGG). Además, en la primera fase de cicatrización, se puede observar una exudación similar a la de la fibrina 2 semanas después del aumento (Kämmerer et al., inédito, Fig. 9 y 10). La reepitelialización del lugar aumentado tarda aproximadamente 4 semanas y la zona normalmente cicatriza sin marcas. Por lo tanto, los resultados estéticos son favorables en comparación con el injerto cutáneo o el FGG. Hegedűs et al y Kämmerer et al., respectivamente, han observado aumentos medios de entre 2,1 mm y 2,7 mm en el ancho de la encía fijada con una contracción de cerca del 25%. Además, los resultados del Dr. Horváth y sus colegas indican que la contracción puede alcanzar el 50% transcurridos 6 meses (Hegedűs et al.). Estos resultados son, bien más favorables que, bien en consonancia con, los resultados de otras matrices de colágeno disponibles en el mercado (Horváth et al 2014, Schmitt et al. 2016). Los expertos concluyeron que un aumento excesivo de, por ejemplo, dos veces el ancho deseado, puede ser recomendado para producir una conveniente banda de la encía fijada de 2-3 mm, algo que podría no considerarse como una desventaja, debido a la fuente ilimitada de xenoinjerto.
En relación con el éxito clínico, el grupo de expertos indicó posteriormente que se puede esperar un resultado clínico más estable y predecible en el maxilar que en la mandíbula. Esto puede deberse a la mayor tensión de insertar fibras musculares. Naturalmente, el cuidado postoperatorio y el control de la placa son puntos esenciales a la hora de lograr un buen resultado. Los pacientes deben abstenerse de cepillarse el lugar receptor durante al menos 2 semanas y utilizar antiséptico como, por ejemplo, clorhexidina al 0,1-0,2% o gel antiséptico. Además, se recomienda una dieta blanda y evitarse una excesiva actividad física.
En resumen, mucoderm® puede ser una alternativa viable al FGG/CTG para ensanchar la mucosa queratinizada, especialmente en casos de cantidad insuficiente y/o discrepancia de color en el FGG/CTG, sin el malestar postoperatorio concomitante asociado con la recogida de un injerto propio.
Acondicionamiento del tejido blando antes y durante la colocación del implante
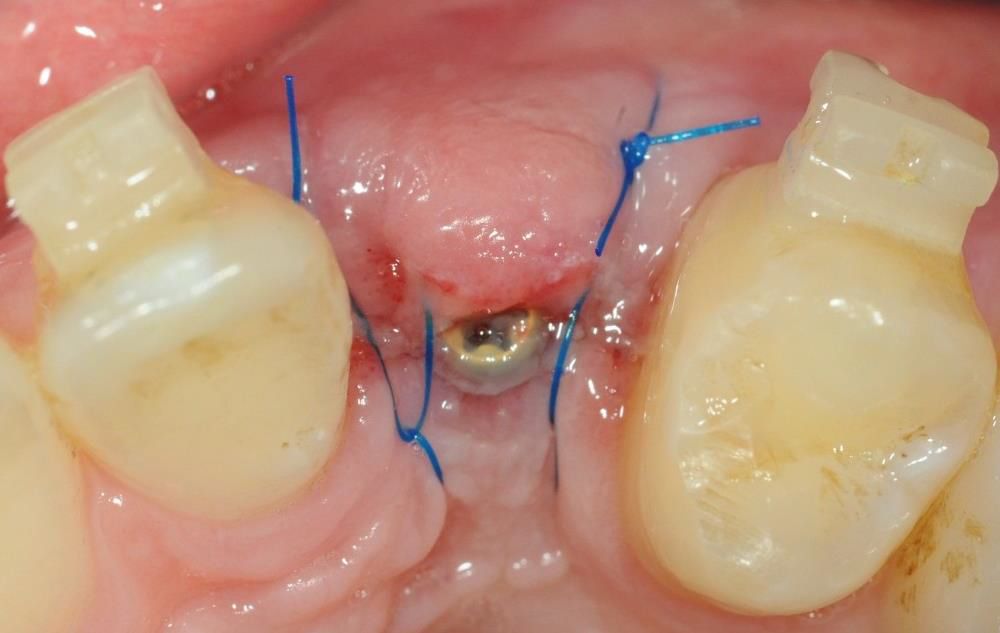
mucoderm® puede usarse para mejorar el contorno del tejido blando en caso de implantación inmediata o sellado de alvéolos de extracción tras la extracción de un diente (Rossi et al. 2016). La cobertura de un alvéolo de extracción con mucoderm® se puede llevar a cabo para mantener el volumen del tejido blando, para aumentar el tejido queratinizado y para proteger el alvéolo o los biomateriales del alvéolo. Uno de los principales beneficios de mucoderm® para el sellado del alvéolo es que su aplicación ayuda a evitar el peligroso desplazamiento coronal de la unión mucogingival causada por el cierre primario forzado de los colgajos.
El grupo de expertos señaló que mucoderm® se puede aplicar para cubrir alvéolos de extracción sin relleno o después de realizar un injerto del alvéolo con un material sustituto óseo o esponja de colágeno. No obstante, la aplicación de un injerto óseo xenogénico o sintético puede ayudar a mantener el volumen de la cresta alveolar, aunque revisiones sistemáticas han mostrado diversos resultados de las técnicas de conservación de la cresta y el sellado del alvéolo con o sin el uso de injertos, especialmente, en evaluaciones histológicas (MacBeth et al. 2016, Horváth et al. 2013). Los resultados de un estudio en curso indican que se pueden obtener resultados predecibles si dos tercios de la matriz se fijan bajo el periostio para que solo quede expuesto un tercio (Rossi et al, inédito, Fig. 11-13). En este estudio se sellaron con mucoderm® 10 alvéolos intactos con paredes bucales intactas y dos tercios de la superficie de la matriz mucoderm® se estabilizaron bajo el tejido marginal con un área de exposición media de 26 mm2. El seguimiento reveló que el cierre del alvéolo tras 8 semanas se mantuvo en 9 de los 10 lugares. Los autores destacaron que en estos casos no son necesarias incisiones de descarga mientras se pueda crear espacio bajo el periostio mediante tunelación. Por tanto, mucoderm® se puede colocar bajo el periostio bucal y lingual e inmovilizarse mediante suturas sobre la matriz.
De este modo, mucoderm® ofrece un atractivo enfoque para sellar alvéolos de extracción. Estudios en curso están investigando la cicatrización en procedimientos de conservación del alvéolo en los que se haya realizado injerto de los alvéolos con biomateriales alogénicos o sintéticos.
Resumen
Tras un enriquecedor debate de los estudios clínicos publicados y las series de casos, así como de los datos clínicos publicados recientemente o en curso sobre el uso de mucoderm® como reemplazo del tejido blando, los expertos han llegado a la conclusión de que la matriz dérmica xenogénica actual podría usarse satisfactoriamente en procedimientos periodontales y relacionados con implantes sin la necesidad de recogida de autoinjerto. No obstante, todos los participantes resaltaron la importancia de la revascularización como el punto más crucial cuando se utiliza mucoderm® en cirugía plástica periodontal, engrosamiento del tejido blando periimplantario, vestibuloplastia o procedimientos de sellado de alvéolos. Los expertos consideraron además que la maleabilidad de mucoderm® es excelente y sencilla, sin necesidad de modificaciones específicas del material. Hubo un amplio consenso en la necesidad de nuevos datos clínicos, especialmente en relación con la estabilidad a largo plazo del resultado clínico, aunque resultados alentadores han demostrado situaciones de tejido blando estable tras el aumento con mucoderm® (Zafiropoulos et al. 2016, Cosgarea et al. 2016, Puisys et al. 2015). Nuevos estudios deben igualmente evaluar las ventajas de la terapia combinada con Emdogain® y/u otros factores de crecimiento. Los expertos propusieron, por consiguiente, el diseño de estudios potenciales para que, junto con los estudios que actualmente se están llevando a cabo, se pueda obtener en el futuro nuevos conocimientos sobre el uso clínico de mucoderm®.