Implantation und simultane Augmentation eines bukkalen Dehiszenzdefektes mittels Guided-Bone-Regeneration
Ein klinischer Fallbericht von Dr. med. dent. Kai Höckl, Deutschland.
Beim vorliegenden Fall handelt es sich um einen 62-jährigen Patienten, Raucher, der mit einem Herzschrittmacher versorgt ist. Er stellte sich mit dem Wunsch der Versorgung einer Schaltlücke regio 24 in der Praxis vor. Die Prognose des furkationsbefallenen Zahnes 26 war als prothetischer Pfeiler zu fraglich, um die Lücke mit einer konventionellen Brückenversorgung zu schliessen. Trotz ausführlicher Aufklärung über das erhöhte Risiko einer periimplantären Entzündung entschied sich der Patient für die implantologische Rekonstruktion (Versorgung mittels einem Straumann® BLT 4,1 x 10 mm RC Implantat). Einer kurzzeitigen Reduktion des Nikotinkonsums stimmte er zu. Nach eingehender klinischer und radiologischer 3D-Diagnostik zeigte sich die Notwendigkeit einer lateralen Augmentation mit xenogenem Ersatzmaterial (Straumann® Xenoflex) und Eigenknochen. Zur Stabilisation des Augmentates und um das Einwachsen von Epithelzellen zu verhindern, wurde eine resorbierbare Perikardmembran (Jason membrane®) eingebracht.
Implantologische Versorgungen benötigen zur langfristigen Stabilität suffiziente knöcherne und weichteilige Verhältnisse.
Gerade im bukkalen Anteil stellt sich jedoch häufig ein durch physiologische Umbauprozesse nach der Zahnextraktion bedingtes Knochendefizit in vertikaler und horizontaler Dimension dar.
Die knöchernen Remodellierungsvorgänge sind Gegenstand zahlreicher wissenschaftlicher Untersuchungen [1, 2]. Diese sind vor allem durch den Abbau des morphologisch zum Parodont zählenden „bundle-bone“ beeinflusst [3, 4]. Daraus resultieren verschiedenartige Defektmorphologien, die durch die 8. Europäische Konsensus Konferenz des BDIZ EDI im Februar 2013 festgelegt wurden (CCARD, BDIZ EDI).
Vor allem horizontale Augmentationen mit geringer Ausdehnung lassen sich vorhersagbar mittels GBR und partikuliertem Knochenersatzmaterial behandeln, da die Regeneration maßgeblich von der Zahl der gebildeten Blutgefäße und der damit einhergehenden Rekrutierung knochenbildender Zellen zusammenhängt. Hierbei hat sich eine Kombination aus autologem Knochen kombiniert mit xenogenem Knochenersatzmaterial bewährt und der Erfolg ist hinreichend wissenschaftlich dokumentiert. [5, 6]
Anamnese
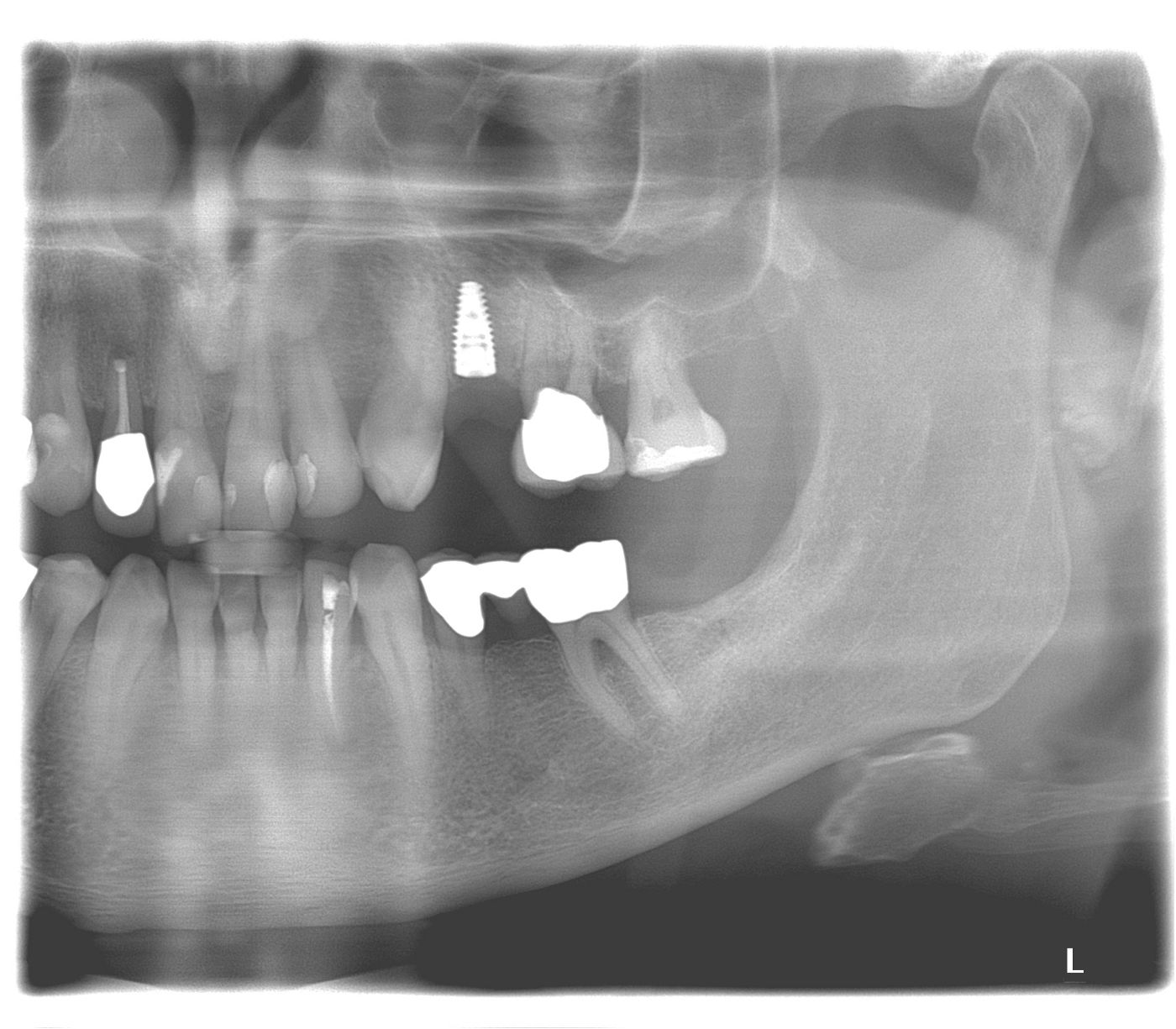
Der Patient stellte sich mit dem Wunsch der Versorgung der Schaltlücke regio 24 (Abb. 1) in unserer oralchirugischen Praxis vor. Die parodontale Vorbehandlung wurde bereits durch den Hauszahnarzt durchgeführt. Jedoch war die Prognose des furkationsbefallenen Zahnes 26 trotz mittlerweile unauffälligen Sondierungstiefen als prothetischer Pfeiler zu fraglich, um die Lücke mit einer konventionellen Brückenversorgung zu schließen.
Der 62-jährige Patient gab an, mit einem Herzschrittmacher versorgt zu sein und ca. 15-20 Zigaretten pro Tag zu rauchen. Medikamente nehme er keine ein. Trotz ausführlicher Aufklärung über das erhöhte Risiko einer periimplantären Entzündung entschied sich der Patient für die implantologische Rekonstruktion. Einer kurzzeitigen Reduktion des Nikotinkonsums stimmte der Patient zu.
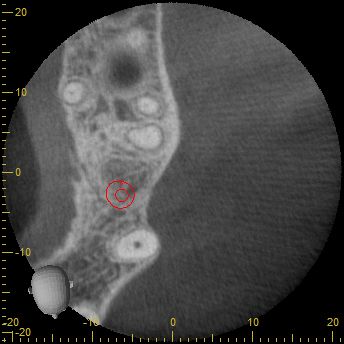
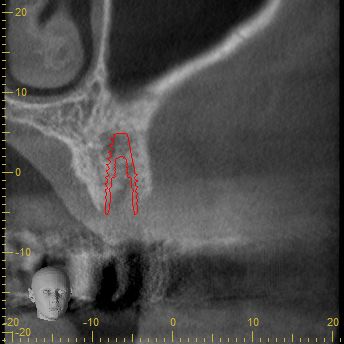
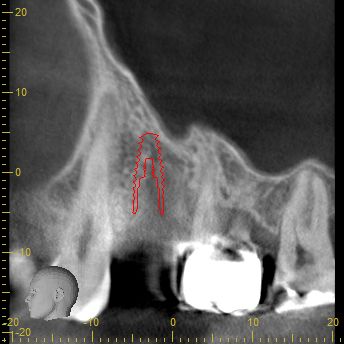
Nach eingehender klinischer und radiologischer 3D-Diagnostik (Abb. 2, 3) wurde der Patient über eine notwendige laterale Augmentation mit xenogenem Ersatzmaterial und Eigenknochen aufgeklärt und die operationsbedingten Risiken wurden mit ihm besprochen.
Behandlungsablauf
Nach perioperativer Antibiotikaprophylaxe mit zwei Gramm Amoxicillin eine Stunde präoperativ und intra- und extraoraler Desinfektion erfolgte die lokale Anästhesie mittels Articain 1:100000 (Septanest, Fa. Septodont) bukkal und palatinal.
Anschließend wurde ein vollschichtiger Mukoperiostlappen mit distaler Entlastung bis zwei Millimeter über die mukogingivale Grenze präpariert (Abb. 4). Apikal der mukogingivalen Grenze wurde die Präparation als Spaltlappen fortgeführt, um einen spannungsfreien Wundverschluss zu ermöglichen.
Nach der Zentrifugation von Eigenblut wurde in dem gewonnenem L-PRF (platelet-rich-fibrin) das Augmentationsmaterial (Straumann® XenoFlex, 100 mg, 6 x 6 x 6 mm) rehydriert (Abb. 5). Mittels Safescraper (Fa. Meta) wurden autologe Knochenchips aus dem OP Bereich gewonnen und ebenfalls in PRF zwischengelagert.
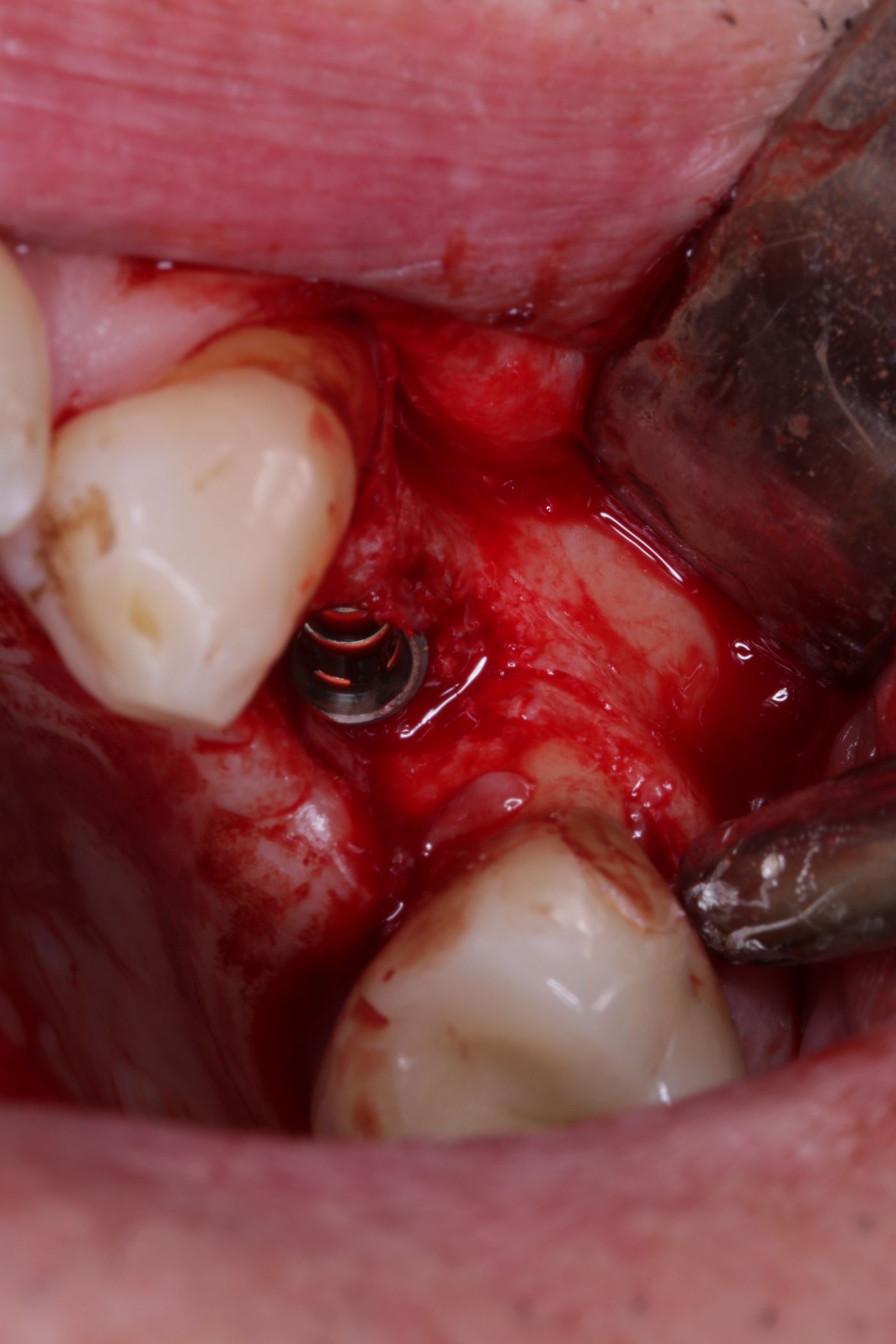
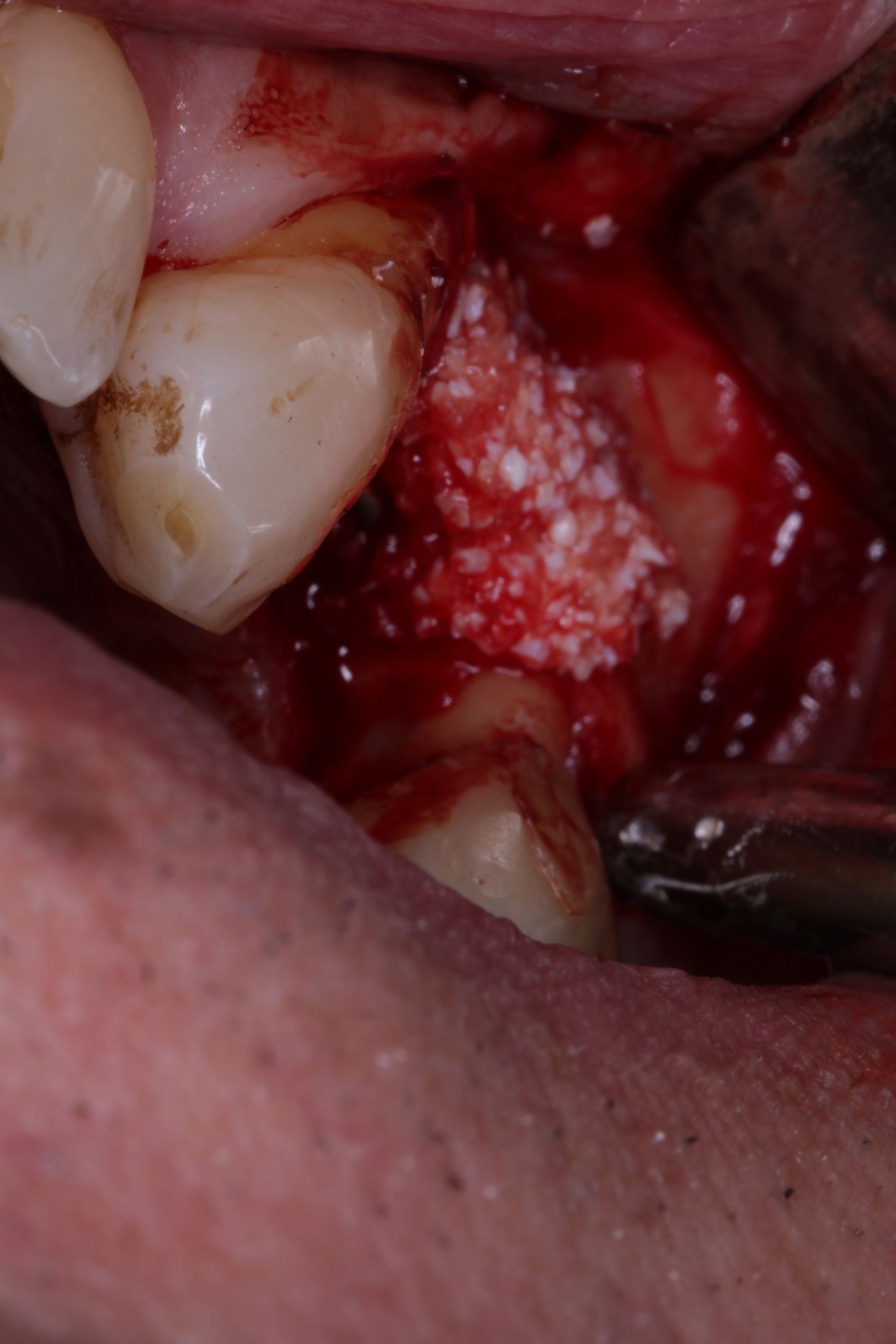
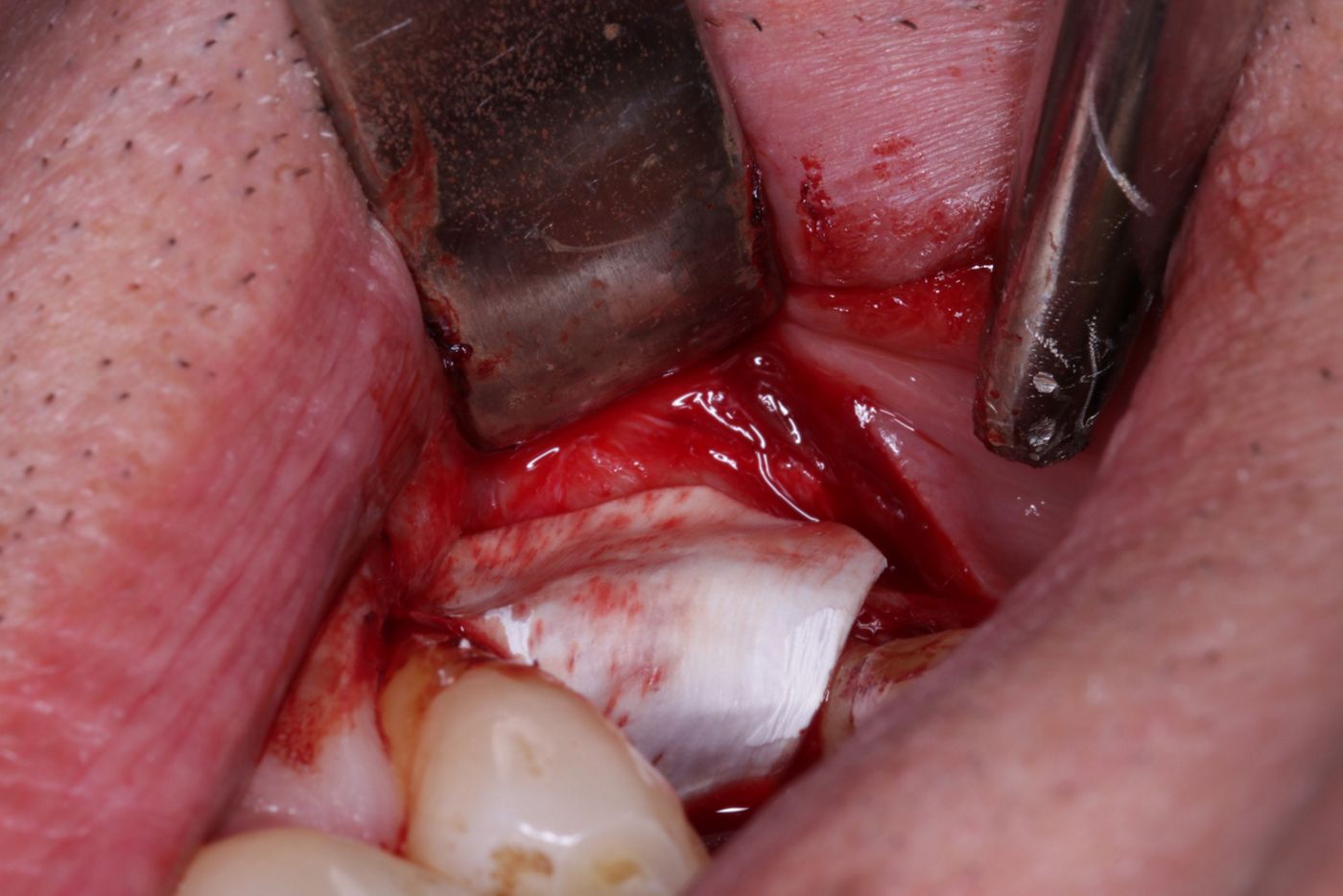
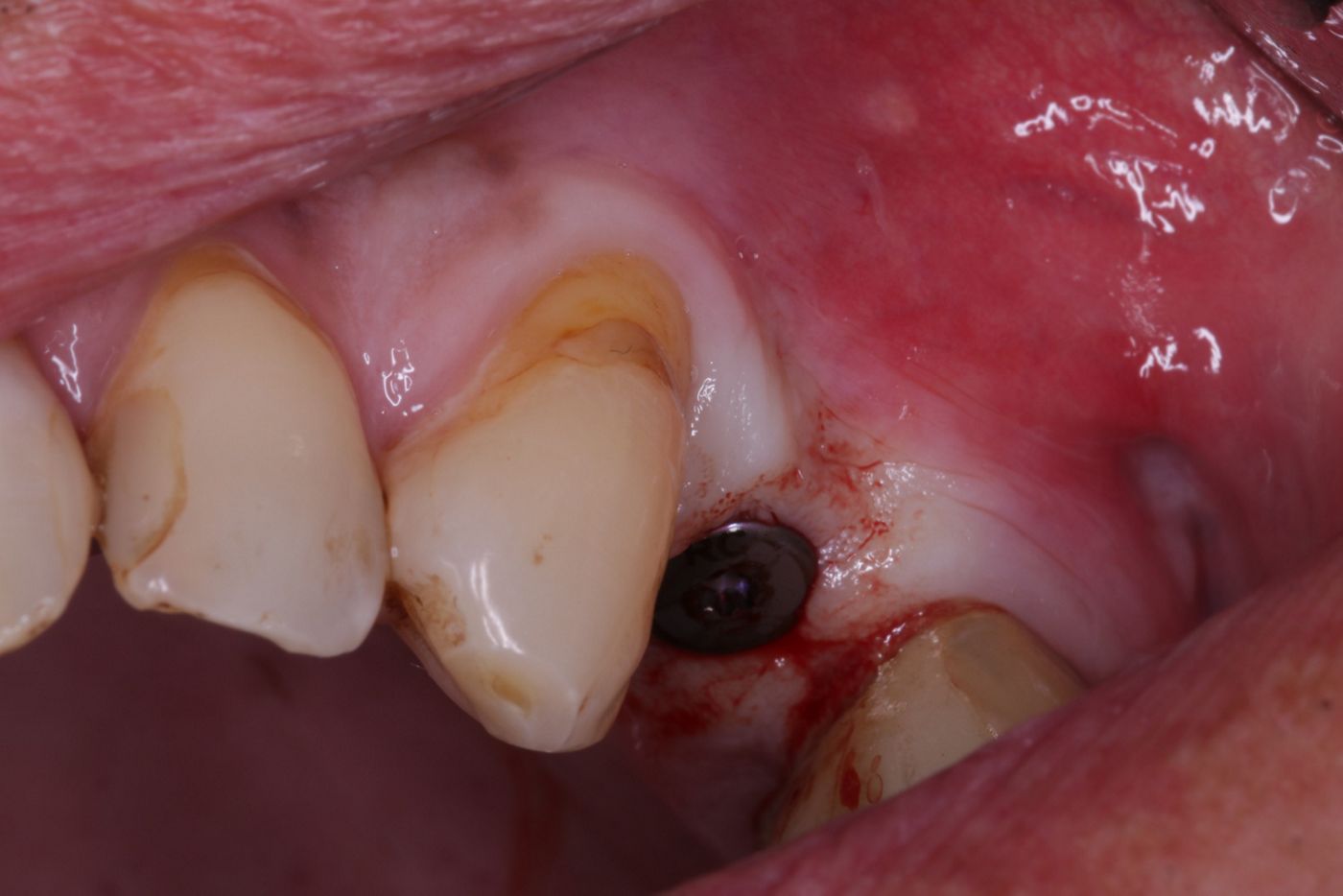
Die Implantatbohrung erfolgte nach Protokoll und es konnte wie geplant ein BLT 4,1 x 10 mm RC Implantat (Straumann) primärstabil inseriert werden. Analog des bereits von Prof. Buser beschriebenem Protokolls [5, 6] wurden die gewonnenen Knochenchips auf die freiliegenden Implantatwindungen aufgebracht und mit xenogenem Knochenersatzmaterial überschichtet (Abb. 6, 7). Zur Stabilisation des Augmentates und um das Einwachsen von Epithelzellen zu verhindern, wurde eine resorbierbare Perikardmembran (Jason membrane®, Straumann Biomaterialien) eingebracht (Abb. 8).
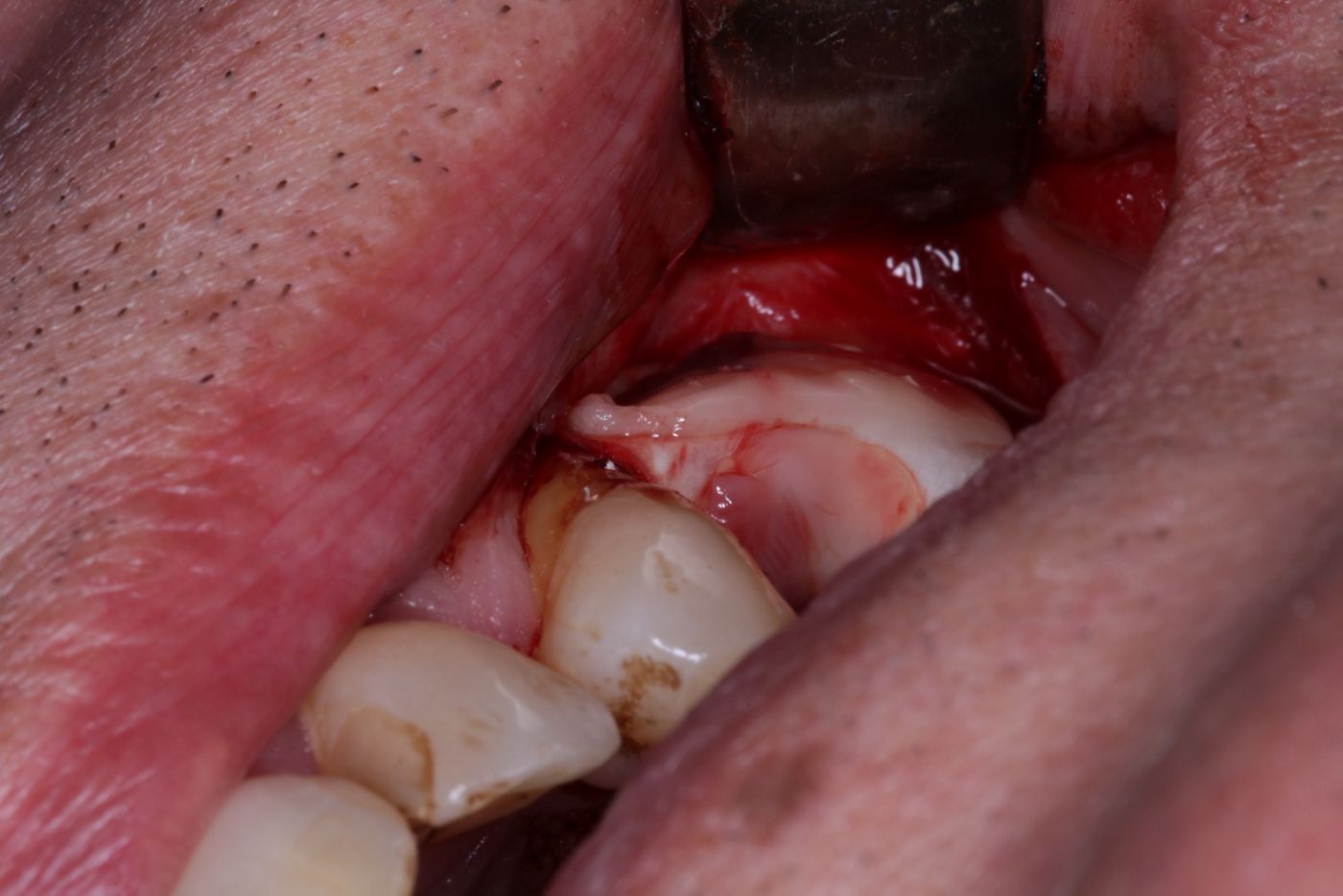
Abschliessend wurden zwei L-PRF Membranen zur Verbesserung der Wundheilung bukkal und krestal aufgelegt und die Wunde wurde mittels nicht resorbierbarem, monofilem Nahtmaterial (4/0 ePTFE und 6/0 Polypropylen/Polyethylen) mehrschichtig verschlossen (Abb. 9 -11).
Der postoperative Verlauf gestaltete sich unter Fortführung der Antibiotikagabe (Amoxicillin 1000 mg 1-1-1 über drei Tage) und zweimal täglicher Spülung mit CHX (0,2%) komplikationslos, sodass die Nähte nach sieben Tagen bei unauffälligen Verhältnissen entfernt werden konnten (Abb. 12).
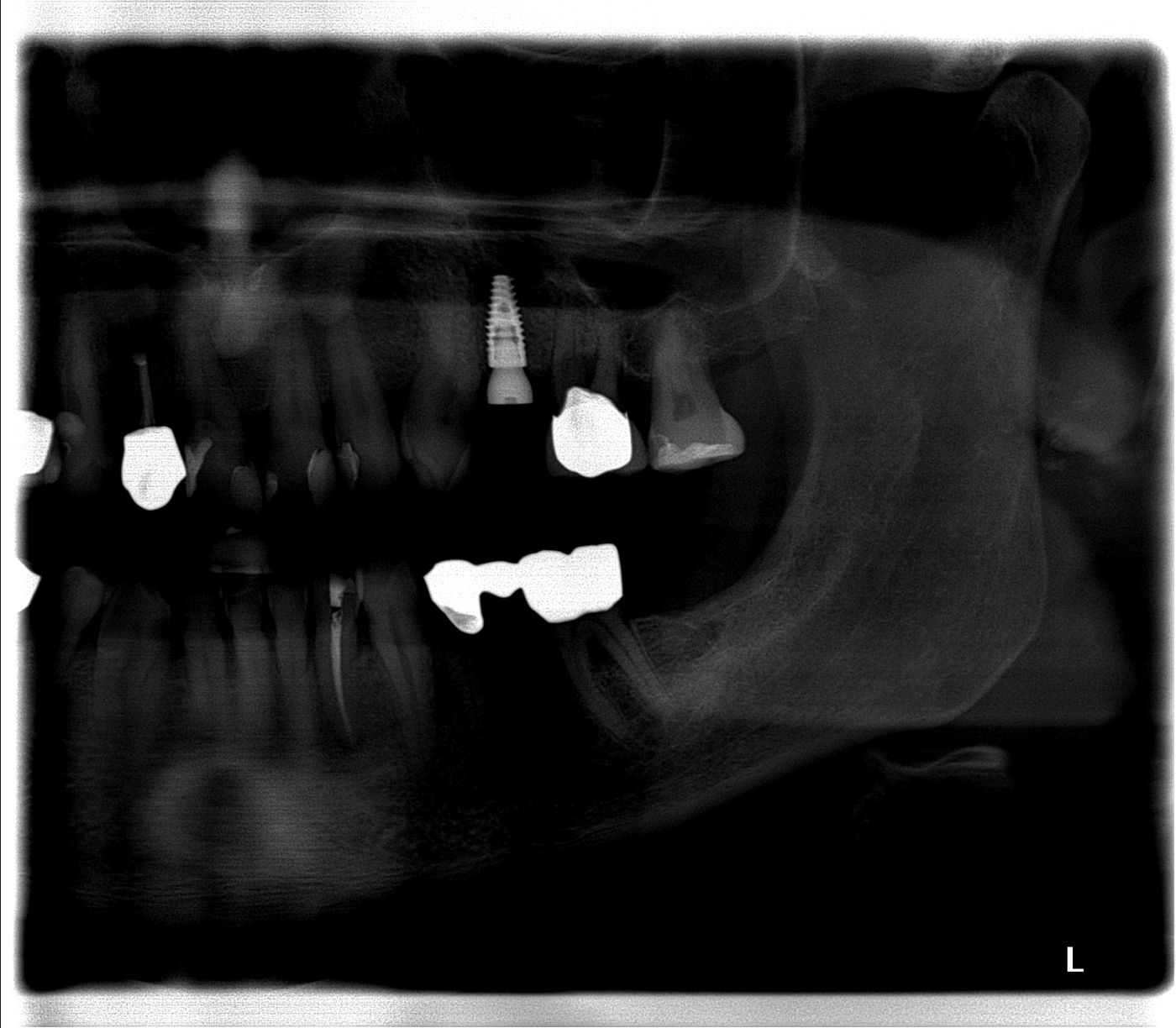
Die Einheilzeit wurde auf fünf Monate festgelegt. Danach stellte sich der Patient zur Freilegung erneut vor. Klinisch stellten sich suffiziente knöcherne und weichgewebige Verhältnisse dar, sodass die Freilegung in Lokalanästhesie durch Stichinzision erfolgen konnte (Abb. 13, 14).
Anschliessend wurde der Patient zu seinem Hauszahnarzt zurücküberwiesen, wo die weitere prothetische Versorgung mittels implantatgestützter Krone erfolgte.
Bei der klinischen Verlaufskontrolle sechs Monate nach Versorgung zeigten sich reizlose periimplantäre Verhältnisse (Abb. 15).
Schlussfolgerung
Mit dem hier vorgestellten Protokoll lassen sich kleine Augmentationen vorhersagbar durchführen.
Der Kollagenanteil in dem hier verwendeten Knochenersatzmaterial Straumann® XenoFlex ermöglicht ein einfacheres Handling im Vergleich zu kollagenfreiem Knochenersatzmaterial und eine bessere Adaptation an den knöchernen Defekt sowie eine Erhöhung der Stabilität.






.JPG?wid=1400)