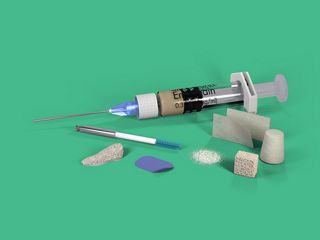
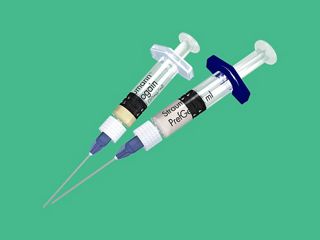
Les solutions de régénération Straumann® sont notre contribution pour régénérer les tissus mous et durs autour des dents et préserver les aspects fonctionnels et esthétiques sur le long terme. Nous ne sommes pas simplement un autre fournisseur ; nous sommes là pour vous aider en vous proposant des solutions scientifiquement éprouvées pour vos cas simples et complexes en matière de préservation des dents, gestion des sites implantaire et préservation des implants.
Domaines d’intérêt
Gamme en bref
En savoir plus
Cas cliniques et articles scientifiques relatifs aux solutions de régénération Straumann® dans notre magazine en ligne.


Gamme de produits de solutions de régénération Straumann®
En savoir plus sur notre gamme de produits Solutions de régénération Straumann®.